
【题目】对拟卤素的性质进行探究,设计了以下实验( )
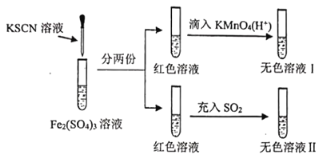
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
【答案】D
【解析】
A、溶液颜色变红是因为铁离子与KSCN发生了络合反应,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,没有沉淀生成,故A错误;
B、红色溶液与酸性高锰酸钾溶液褪色,表现了SCN-的还原性,与二氧化硫褪色,体现了铁离子的氧化性,故B错误;
C、溶液颜色变红时发生反应的离子方程式是Fe3++3SCN-=Fe(SCN)3,该反应没有生成(SCN)2,不能说明三价铁离子的氧化性强于(SCN)2,故C错误;
D、无色溶液Ⅱ中含有亚铁离子和SCN,根据分析SCN与氯离子相似,具有还原性,亚铁离子的还原性强于氯离子,根据拟卤素的化学性质均与卤素单质相似,所以亚铁离子的还原性强于SCN,即滴入适量的KMnO4(H+)溶液,先将亚铁离子氧化为三价铁离子,溶液又变成红色,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。
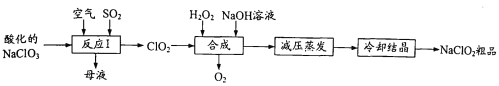
己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
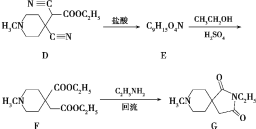
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):
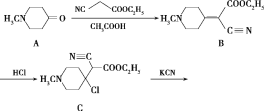
(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填表
微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
| __________ | ____________ | _________ | _________ |
| _________ | ___________ | _________ | ____________ |
| ___________ | ________ | ______ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
①Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子 ,因此还原性Al>Mg;
②氧化剂具有氧化性;
③有单质参加的反应一定是氧化还原反应;
④2Fe+3Cl2![]() 2FeCl3;Fe+S
2FeCl3;Fe+S![]() FeS,由此可以判断氧化性:Cl2>S
FeS,由此可以判断氧化性:Cl2>S
⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
A.②③④ B.②④ C.①②⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
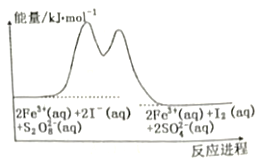
A. 化学反应速率与Fe3+浓度的大小有关
B. 该反应为吸热反应
C. Fe2+是该反应的催化剂
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com