
分析 该反应中Cl元素化合价由0价变为+5价、-1价,其转移电子数为5,氯气既作氧化剂又作还原剂,且有$\frac{1}{6}$的氯气作还原剂、$\frac{5}{6}$的氯气作氧化剂,NaCl是还原产物、NaClO3是氧化产物,当5mol电子转移时,有1molNaClO3生成,据此分析解答.
解答 解:该反应中Cl元素化合价由0价变为+5价、-1价,其转移电子数为5,氯气既作氧化剂又作还原剂,且有$\frac{1}{6}$的氯气作还原剂、$\frac{5}{6}$的氯气作氧化剂,所以氧化剂和还原剂的物质的量之比=$\frac{5}{6}$:$\frac{1}{6}$=5:1;NaCl是还原产物、NaClO3是氧化产物,当5mol电子转移时,有1molNaClO3生成,所以氧化产物的物质的量是1mol,
故答案为:1;5:1.
点评 本题考查氧化还原反应的计算,侧重考查基本概念及计算,正确判断氧化剂、还原剂的物质的量之比是解本题关键,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1:2 | B. | 4:3:5 | C. | 1:2:1 | D. | 6:7:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0价 | B. | +1价 | C. | -1价 | D. | -2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
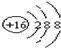 ,Br -的电子式:
,Br -的电子式: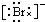 ,CO2的结构式:O=C=O
,CO2的结构式:O=C=O
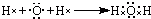 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石的网状结构中,最小的环上有6个碳原子 | |
| B. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 在氯化铯晶体中,每个氯离子周围最近且等距离的氯离子有8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用1L水里含有溶质物质的量来表示的浓度叫做物质的量浓度 | |
| B. | 用一定量溶液里含有溶质的多少来表示的浓度叫做物质的量浓度 | |
| C. | 用1L溶液里含有溶质的量来表示的浓度叫做物质的量浓度 | |
| D. | 用1L溶液里含有多少摩尔溶质来表示的浓度叫做物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a>b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 密闭容器中X和Y的物质的量之比为1:2时,该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn是三种同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com