
| A. | 2H++2e-=H2↑ | B. | Fe=Fe2++2e- | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH-=2H2O+O2↑+4e- |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
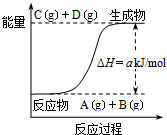
| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
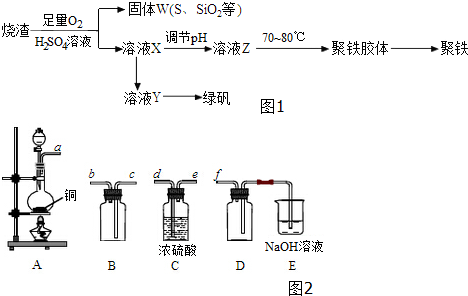
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
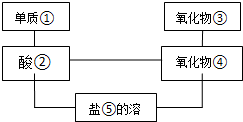 给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.
给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离酒精和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置②中若装满水,收集H2的时候应该从a口通入H2 | |
| D. | 装置①用CCl4萃取碘水中的碘时,CCl4层在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
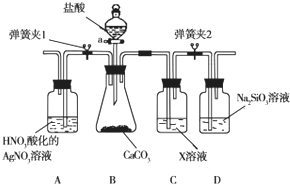 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com