
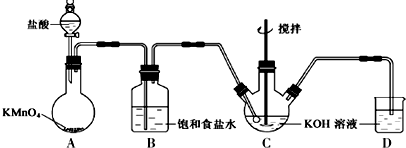
分析 根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,制得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收.
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,结合得失电子守恒和原子守恒书写成离子方程式;根据HCl易溶于饱和食盐水,而氯气不溶分析;
(2)根据反应温度反应在0℃~5℃选择装置C应放在冰水浴中,根据充分利用原料,应降低通入氯气的速率分析;
(3)根据K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解分析;
(4)根据含有Fe(OH)3、KCl等杂质,氢氧化铁用砂芯漏斗过滤除去,再由于K2FeO4可溶于水、微溶于浓KOH溶液,所以将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体从而除去KCl,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
解答 解:(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,所以离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;HCl;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,故答案为:缓慢滴加盐酸、装置C用冰水浴中;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,
故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥,
故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥.
点评 本题考查实验制备方案、氧化还原反应、物质的分离提纯、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,等物质的量O2的和CO所含的分子数必相等 | |
| B. | 0.012 kg 12C 含有约6.02×1023个碳原子 | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
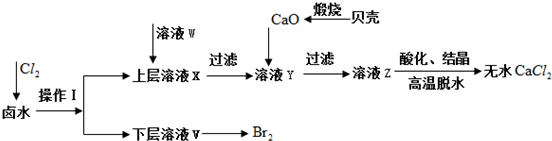
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=1.5 mol•L-1•min-1 | B. | v(B)=3 mol•L-1•min-1 | ||
| C. | v(D)=2 mol•L-1•min-1 | D. | v(C)=1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +7 | B. | +6 | C. | +5 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入氢氧化钠溶液 | |
| B. | 硫酸铜溶液中逐滴加入氢氧化钡溶液 | |
| C. | 硫酸中逐滴加入氯化钡溶液 | |
| D. | 盐酸中逐滴加入硝酸银溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com