
【题目】取25.0gCuSO45H2O晶体,加热使之均匀、缓慢升温至1000℃并恒温1小时,试通过计算回答下列问题(如果是混合物,要算出混合物中各组分的质量):
(1)在某中间温度时,固体产物质量是否可能为10g?
(2)不考虑实验带来的误差,在反应条件下,反应气态产物除去水后,物质的量可能为
A.0mol
B.0.1mol
C.大于0.1mol
(3)你认为最终固体产物为多少克?产物颜色如何?
(4)如果某同学做此实验时最后固体质量为7.6g,试计算其组分.
【答案】
(1)解:发生的反应有:CuSO45H2O ![]() CuSO4+5H2O↑、CuSO4
CuSO4+5H2O↑、CuSO4 ![]() CuO+SO3↑、4CuO
CuO+SO3↑、4CuO ![]() 2Cu2O+O2↑ 等,n(CuSO45H2O)=
2Cu2O+O2↑ 等,n(CuSO45H2O)= ![]() =0.1mol,
=0.1mol,
若产物全部是CuSO4,则m(CuSO4)=0.1mol×160g/mol=16g;
若产物全部是CuO,则m(CuO)=0.1mol×80g/mol=8g,
所以10g固体中含有CuSO4和CuO,设CuSO4和CuO分别为x、y,则:
x+y=0.1mol
160x+80y=10g
解得:x=0.025mol y=0.075mol
则:m(CuSO4)=0.025mol×160g/mol=4g m(CuO)=0.075mol×80g/mol=6g
答:固体产物质量是否可能为10g,其中CuSO4为4g、CuO为6g
(2)C
(3)解:此反应条件下,最终固体产物为Cu2O,设质量为x,
2CuSO45H2O | ~ | Cu2O |
2×250 | 144 | |
25.0g | x |
解得x=7.2g,
答:终固体产物为7.2g,颜色为红色
(4)解:若产物全部是CuO,则质量为m(CuO)=0.1mol×80g/mol=8g;
若产物全部是Cu2O,则质量为m(Cu2O)=0.1mol× ![]() ×144g/mol=7.2g,
×144g/mol=7.2g,
所以7.6g固体中含有Cu2O和CuO.
设Cu2O和CuO分别为amol、bmol,则:
2a+b=0.1mol
144a+80b=7.6g
解得:a=0.025mo b=0.05mol
即m(Cu2O)=0.025mol×144g/mol=3.6g m(CuO)=0.05mol×80g/mol=4g,
答:Cu2O为3.6g,CuO为4g.
【解析】解:(2)根据反应:CuSO4 ![]() CuO+SO3↑,4CuO
CuO+SO3↑,4CuO ![]() 2Cu2O+O2↑,
2Cu2O+O2↑,
则有:n(SO3)=n(CuSO4)=0.1mol,n(O2)= ![]() n(CuO)=
n(CuO)= ![]() ×0.1mol=0.025mol
×0.1mol=0.025mol
则n(SO3)+n(O2)=0.1mol+0.025mol=0.125mol,
又:2SO3 ![]() 2SO2+O2 , 若SO3完全分解,则气体的物质的量最多为0.1mol×
2SO2+O2 , 若SO3完全分解,则气体的物质的量最多为0.1mol× ![]() +0.025mol=0.175mol,所以气体的物质的量准确的范围是0.125<n<0.175,故选:C;
+0.025mol=0.175mol,所以气体的物质的量准确的范围是0.125<n<0.175,故选:C;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是( ) 
A.图1表示常温下向体积为10 mL 0.1 molL﹣1NaOH溶液中逐滴加入0.1 molL﹣1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH﹣)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJmol﹣1
D.由图4得出若除去CuSO4溶液中的Fe3+ , 可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟各物质浓度变化正确的是( )
A.NH3:0.002 molL﹣1
B.H2O:0.002 molL﹣1
C.NO:0.001 molL﹣1
D.O2:0.001 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
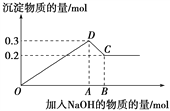
(1)写出代表各线段发生的反应的离子方程式:
OD段________________________________________________,
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。
(3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。
(4)图中线段OA∶AB=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CON2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( ) 
A.加催化剂
B.降低温度
C.增大NO的浓度
D.缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5molSO2、4molO2 , 经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为多少 .
(2)平衡时O2的转化率为 .
(3)平衡时O2在反应混合气中的物质的量分数 .
(4)平衡常数K值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A. 22.4LO2中含有NA个氧分子
B. 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L
C. 标准状况下,22.4LH2O中含有的水分子数是NA个
D. 3.4gNH3含有的氨分子数为0.2NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com