
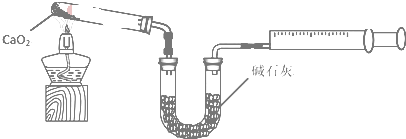
分析 CaO2工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30%H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2.
(1)第①步中氯化铵和氢氧化钙发生复分解反应生成一水合氨和氯化钙;
第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵;
H2O2价格较高且易分解;
(3)实验室用硝酸酸化的硝酸银溶液检验;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
(5)根据过氧化钙和氧气之间的关系式计算;
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
解答 解:(1)第①步中氯化铵和氢氧化钙发生复分解反应生成一水合氨和氯化钙,反应方程式为2NH4Cl+Ca(OH)2=2NH3•H2O+CaCl2;
第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
故答案为:2NH4Cl+Ca(OH)2=2NH3•H2O+CaCl2;CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl,
故答案为:NH4Cl;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水反应生成氢氧化钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和水反应、防止过氧化钙分解;
(5)设超氧化钙质量为x,
2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{1400m}$×100%,=$\frac{9V}{14m}$%,
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量,
样品质量和反应后固体质量,
故答案为:$\frac{9V}{14m}$%;样品质量和完全分解反应后剩余固体质量.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、化学反应方程式的书写、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧气和臭氧互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$ He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$ He的最外层电子数为2,所以${\;}_{2}^{3}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
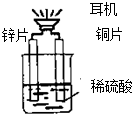
| A. | 铜片表面有气泡产生 | |
| B. | 装置中存在化学能→电能→声能的能量转化 | |
| C. | 如果将铜片换成铁片,电路中的电流方向将改变 | |
| D. | 如果将锌片换成铁片,耳机还能发声 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打-NaHCO3 | B. | 胆矾-CuSO4 | C. | 酒精-C2H5OH | D. | 生石灰-Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
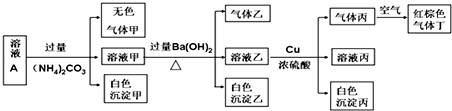
| A. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| B. | 该溶液A中一定有NO3-、Al3+、SO42-、Cl- | |
| C. | 实验消耗Cu 14.4 g,则生成气体丙为3.36L | |
| D. | 生成的甲、乙、丙气体均为无色的易溶于水气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com