
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O. 分析 (1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算;
(2)浓硫酸增重7.2g为水的质量,碱石灰增重17.6g为二氧化碳质量,计算有机物、水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,根据元素守恒来确定有机物的分子式;
(3)能与足量的NaHCO3粉末反应,说明含有-COOH,根据生成的二氧化碳的物质的量确定-COOH数目,能与钠反应生成氢气,结合生成氢气的物质的量确定是否含有-OH及羟基数目;
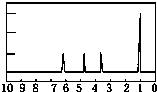
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,结合由A的分子式、含有的官能团及核磁共振氢谱书写其结构简式;
(5)A的结构简式: ,两分子的A形成环状化合物为
,两分子的A形成环状化合物为 ,为酯化反应.
,为酯化反应.
解答 解:(1)由其密度是相同条件下H2的45倍,可知A的相对分子质量为45×2=90,
故答案为:90;
(2)由题意可推知:n(A)=$\frac{9.0g}{90g/mol}$=0.1 mol,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3 mol,n(H)=2n(H2O)=2×$\frac{5.4g}{18g/mol}$=0.6 mol,
n(O)=$\frac{9g-0.3×12g-0.6×1g}{1g/mol}$=0.3 mol,
所以A的分子式为:C3H6O3,
故答案为:C3H6O3;
(3)0.1 mol A与NaHCO3反应放出0.1 mol CO2,则说A中应含有一个羧基,而与足量金属钠反应则生成0.1 mol H2,说明A中还含有一个羟基,
故答案为:-COOH、-OH;
(4)核磁共振氢谱中有4个吸收峰,可知A中应含有4种不同环境的氢原子,A的结构简式为: ,
,
故答案为: ;
;
(5)A为 ,两分子的A形成环状化合物为
,两分子的A形成环状化合物为 ,则方程式为2
,则方程式为2 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O,
+2H2O,
故答案为:2 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O.
点评 本题考查有机物的结构和性质,为高考常见题型,题目难度中等,侧重考查学生对知识的整合能力,注意掌握常见有机物结构与性质,根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团类型为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | |
| B. | 工业上电解熔融状态的MgCl2制备Mg | |
| C. | 工业上利用合成氨实现人工固氮 | |
| D. | 实验室用NH4Cl和Ca(OH)2制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
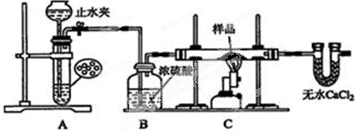
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2 CH2OH+HBr$\stackrel{△}{→}$CH3CH2 CH2Br+H2O | |
| B. | 1-溴丙烷与氢氧化钠溶液共热:CH3CH2 CH2Br+NaOH$→_{△}^{水}$CH3CH2 CH2OH+NaBr | |
| C. | 苯酚钠中通入少量二氧化碳:2 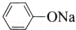 +CO2+H2O→2 +CO2+H2O→2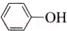 +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硫酸}$C6H12O6(果糖)+C6H12O6(葡萄糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A钻木取火 | B电暖扇取暖 | C酒精灯燃烧 | D燃煤发电 |
| 图片 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com