
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
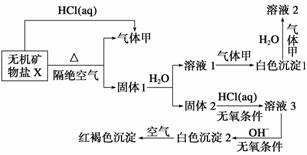
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。
请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式______________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________________________________(用化学反应方程式表示)。
答案 (1)
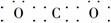
(2)CaFe(CO3)2 CaFe(CO3)2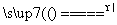 CaO+FeO+2CO2↑
CaO+FeO+2CO2↑
(3)4Fe(OH)2+2H2O+O2===4Fe(OH)3
解析 因X与盐酸反应生成气体甲,则X应为弱酸盐,又因X受热分解可生成气体甲和固体1,可推知固体1应为金属氧化物。因固体1中有与水反应的物质,且溶液1中通入气体甲先出现白色沉淀1后溶解,可推知固体1中含有CaO,气体甲为CO2。根据白色沉淀2遇到空气变为红褐色沉淀,可知X中含有Fe2+。综上分析,X应含有FeCO3和CaCO3。
(1)白色沉淀1为CaCO3,钙原子的结构示意图为 ;CO2为共价化合物,C、O原子间以共价键结合,其电子式为
;CO2为共价化合物,C、O原子间以共价键结合,其电子式为 。
。
(2)10.80 g X完全分解生成CO2的质量为10.80 g-6.40 g=4.40 g,其物质的量为0.10 mol,根据CaCO3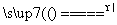 CaO+CO2↑、FeCO3
CaO+CO2↑、FeCO3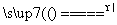 FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2
FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2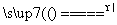 CaO+FeO+2CO2↑。
CaO+FeO+2CO2↑。
(3)Fe(OH)2被空气中的O2氧化为Fe(OH)3,其化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3。


科目:高中化学 来源: 题型:
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1HCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,每个离子都能影响水的电离平衡的一组是( )
A.Zn2+、Ag+、HCO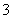 、Cl-、PO
、Cl-、PO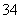 、SO
、SO B.Fe3+、Br-、Al3+、H+、CO
B.Fe3+、Br-、Al3+、H+、CO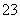 、H2PO
、H2PO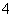
C.Ag+、SO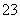 、SiO
、SiO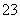 、Fe2+、S2- D.Fe2+、ClO-、NO
、Fe2+、S2- D.Fe2+、ClO-、NO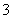 、HS-、Cu2+、HSO
、HS-、Cu2+、HSO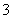
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所列各组物质中,物质之间通过一步反应就能实现如下图所示转化的是( )
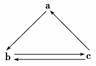
| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应有广泛应用。
(1)我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。
上述反应中,如1.5 mol还原剂________(填“得到”或“失去”)________ mol电子,则生成________ g还原产物。
(2)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH1=-3 352 kJ·mol-1
Mn(s)+O2(g)===MnO2(s) ΔH2=-521 kJ·mol-1
Al与MnO2反应冶炼金属Mn的热化学方程式是________________。
(3)高温电解技术能高效实现CO2(g)+H2O(g)===CO(g)+H2(g)+O2(g),工作原理示意图如下:
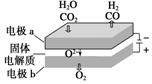
①电极b发生________(填“氧化”或“还原”)反应;
②CO2在电极a放电的反应式是__________________。
(4)黑色沉淀CuS、Cu2S放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活密切相关,下列与化学有关的说法不正确的是
A.化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶
B.开发和推广新能源是实现低碳生活的途径之一
C.粮食酿酒主要经过了淀粉→葡萄糖→乙醇的化学变化过程
D.化学药品着火,都要立即用水或泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)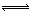 2ClNO(g) ∆H1 < 0 其平衡常数为K1
2ClNO(g) ∆H1 < 0 其平衡常数为K1
b、2NO2(g)+NaCl(s)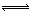 NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)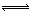 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
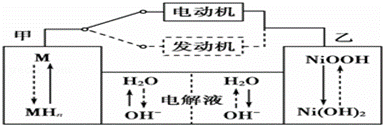
其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
假若你是卫生防疫人员,为配制0.01 mol·L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
A.取KMnO4样品时不慎在表面沾了点蒸馏水
B.溶解搅拌时有液体飞溅出
C.定容时俯视容量瓶刻度线
D.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,
Fe3+在pH=5时已完全沉淀,其中分析错误的是
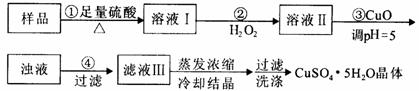
A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=F e3++2H2O
e3++2H2O
C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次
D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com