
【题目】W、X、Y、Z、M均为短周期元素且原子序数依次增大,W和X同族。Y原子最外层电子数是W与X原子最外层电子数之和的3倍,是Z原子最外层电子数的2倍,M的最高正价与最低负价代数和为6。下列说法正确的是
A.离子半径:W-<X+
B.化合物XZW4的结构如图所示,且有还原性
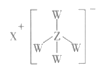
C.工业上可以用电解Z、M的熔融态化合物制备Z单质
D.W与Y形成的化合物均不能使品红溶液褪色
【答案】B
【解析】
W和X同族,Y原子最外层电子数是W与X原子最外层电子数之和的3倍,8以内符合的只有6,即Y最外层电子数为6,则W、X最外层电子数为1,Z最外层电子数为3,M的最高正价与最低负价代数和为6,故M最外层电子数为7,因W、X、Y、Z、M均为短周期元素且原子序数依次增大,故W、X、Y、Z、M分别为H、Li、O、Al、Cl。
A.H-和Li+具有相同的核外电子排布,核电荷数越小,半径越大,故H->Li+,A错误;
B. Al处于分界线附近,具有一定的金属性和非金属性,与非金属元素形成共价键,Li为活泼金属容易失去电子形成离子键,其中H为-1价,处于最低价态,具有还原性,B正确;
C.工业上用电解熔融氧化铝的方法冶炼Al,C错误;
D.H2O2具有强氧化性,能使品红褪色,D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主法错误的是

A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIn在水溶液中存在以下电离平衡:HIn(红色)![]() H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
A. ①④⑤ B. ②⑤⑥ C. ①④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明乙烯能被酸性KMnO4溶液氧化,某小组按下图装置制备乙烯并检验其化学性质。完成下列填空:
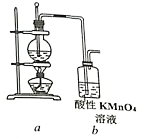
(1)首先检验该装置气密性。检验气密性的操作是:_____________。
(2)向圆底烧瓶中加入药品的顺序是:先加入_____,再缓慢加入____,最后再加入几粒碎瓷片。
(3)加热圆底烧瓶,使温度迅速上升到________℃,观察到烧瓶中的无色液体逐渐变黑。该黑色的物质是_______。
(4)酸性KMnO4溶液很快褪色,但不能说明乙烯具有还原性。理由是:_______________。
(5)选用下列装置(可重复使用也可不用)来证明乙烯具有还原性,请将装置按编号依次排列,并在装置序号对应位置的下一行写出装置内所放的药品。

装置a→_____________________________→b。
药品:(a药品略)_________________________(b酸性KMnO4溶液)。
(6)若将b中酸性KMnO4溶液换成溴水,溴水也能褪色且可观察到b底部有少量无色油状液体生成,如何通过实验证明该无色油状液体中含有溴元素?______。如何通过实验证明乙烯和溴水发生的是加成反应而不是取代反应?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.FeCl3溶液和Cu混合:FeCl3+Cu = Fe2++Cu2+ +3Cl-
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣![]() HCOO﹣+NH
HCOO﹣+NH![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
C.碳酸氢钠的水解方程式:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++2HCO![]() +2NH3H2O=CaCO3↓+2H2O+2NH
+2NH3H2O=CaCO3↓+2H2O+2NH![]() +CO
+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com