
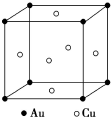
 金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).
金和铜可以形成多种金属化合物,其中一种晶体的结构如图所示(为面心立方体结构).分析 (1)利用均摊法计算该晶胞中Au、Cu原子个数,从而确定其化学式;
(2)该晶胞中面上的两个Au原子和一个Cu原子紧密相邻,棱上的两个Au原子距离最近,距离最近的两个Au原子核间距=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$.
解答 解(1)该晶胞中Cu原子个数=6×$\frac{1}{2}$=3,Au原子个数=8×$\frac{1}{8}$=1,则该晶胞中含有3个Cu原子、1个Au原子,所以其化学式为AuCu3,故答案为:AuCu3;
(2)该晶胞中面上的两个Au原子和一个Cu原子紧密相邻,棱上的两个Au原子距离最近,距离最近的两个Au原子核间距=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$=$\root{3}{\frac{\frac{64×3+197}{{N}_{A}}}{d}}$cm=$\root{3}{\frac{389}{d{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{389}{d{N}_{A}}}$.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,注意晶胞公式中各个字母的含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷和2-甲基丁烷 | B. | 戊烷和环己烷 | ||
| C. | 丙烷和2-甲基丙烷 | D. | 2,3-二甲基丁烷和和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃15mL、3mol•L-1的X溶液 | B. | 10℃30mL、1mol•L-1 的X溶液 | ||
| C. | 10℃30mL、2 mol•L-1 的X溶液 | D. | 10℃10mL、4mol•L-1 的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
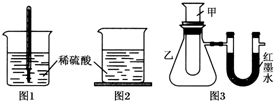
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com