
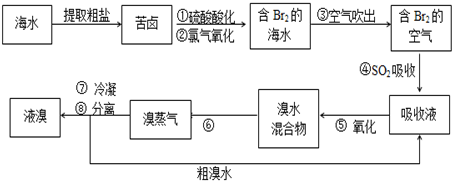
分析 (1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,氯气能将溴离子氧化为溴单质,即Cl2+2Br-=Br2+2Cl-;
(2)根据了SO2的还原性和氯气的氧化性来书写二者之间的反应;
(3)沸点不同的互溶物质的分离可以采用蒸馏法;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(5)根据信息:SCN-称为“类卤离子”,结合反应Br2+SO2+2H2O=4H++2Br-+SO42-来回答,另一种原因是三价铁离子与二氧化硫发生氧化还原反应生成了二价铁离子.
解答 解:(1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,氯气能将溴离子氧化为溴单质,即Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(2)SO2和氯气、水反应生成硫酸和氢溴酸,即:Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)溴水的混合物中,将溴单质和水分离得到溴蒸汽可以采用蒸馏法,
故答案为:蒸馏;
(4)反应中Br2起氧化剂、还原剂作用,根据关系式可知,
3Br2~NaBrO3~5NaBr~5e-,
3 5
1mol $\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
(5)将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失,因为SCN-称为“类卤离子”,根据反应:Br2+SO2+2H2O=4H++2Br-+SO42-,推得,红色消失的过程中发生反应:2Fe(SCN)3+SO2+2H2O=2Fe2++SO42-+6SCN-+4H+,
还有一种可能是三价铁离子与二氧化硫发生氧化还原反应生成了二价铁离子:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe(SCN)3+SO2+2H2O=2Fe2++SO42-+6SCN-+4H+或2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水晶和陶瓷都是传统硅酸盐材料 | |
| B. | 可溶性铝盐和铁盐可用作净水剂 | |
| C. | SO2和NO都能形成酸雨而破坏环境 | |
| D. | CO2和CH4都是引起温室效应的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
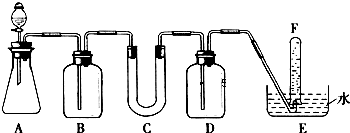
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的最高价氧化物对应的水化物的酸性比E强 | |
| B. | 某物质焰色反应呈黄色,该物质一定是含C的盐 | |
| C. | 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红 | |
| D. | B的氢化物的沸点一定高于A的氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com