
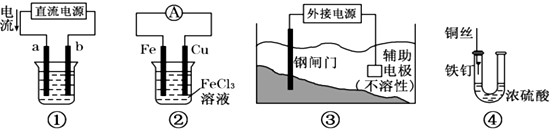
分析 (1)有外接电源的装置属于电解池;
(2)电解精炼铜时,粗铜作阳极,硫酸铜溶液为电解质溶液;
(3)Fe与氯化铁溶液反应生成氯化亚铁.
解答 解:(1)装置①③都有外接电源,属于电解池,利用了电解原理;
故答案为:①③;
(2)装置①若用来精炼铜,电流从电源的正极流出,流入a电极,则a为阳极,电解精炼铜时,粗铜作阳极,所以a极的电极材料是粗铜,含有铜离子的溶液为电解质溶液,则可以用硫酸铜溶液作电解质溶液;
故答案为:粗铜;CuSO4溶液;
(3)装置②中,Fe为负极失电子生成亚铁离子,Cu为正极,正极上铁离子得电子生成亚铁离子,则总反应方为Fe与氯化铁溶液反应生成氯化亚铁,总反应方程式是Fe+2FeCl3═3FeCl2;
故答案为:Fe+2FeCl3═3FeCl2.
点评 本题考查了原电池原理和电解池原理、金属的电化学腐蚀和防护,侧重于考查学生对基础知识的应用能力,题目难度不大,注意把握电极的判断和电极方程式的书写.


科目:高中化学 来源: 题型:解答题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
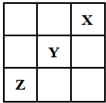 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L SO3分子含有的硫原子数为1.5NA | |
| B. | 1 mol/L KI溶液中I-数目为NA | |
| C. | 0.1 mol Na+离子中所含的电子数为3.4 NA | |
| D. | 56g铁与足量的Cl2或S反应时转移电子数均为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com