

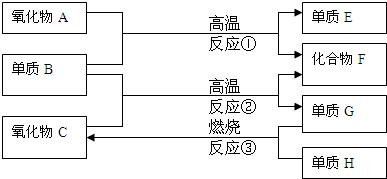
①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。?
据此,请填空:?
(1)化合物F是___________________。?
(2)氧化物A是___________________。?
(3)反应③的化学方程式是___________________________________________________。
(4)反应④的化学方程式是___________________________________________________。
解析:本题用框图推断的方式考查非金属元素及其化合物的性质,重点是碳族的硅和二氧化硅;卤族的氟和氟化氢。常见的可作半导体材料的单质是硅(Si),工业上通常用碳与SiO2反应制粗硅,反应方程式为:SiO2+2C![]() Si+2CO↑,F即CO,为不成盐氧化物。单质碳与什么氧化物反应生成CO和另一种单质呢?再从题中另一突破口入手:I是酸性物质,能与SiO2反应,就已学过的知识分析,SiO2是酸酐,与一般的酸不反应,唯独与HF反应:SiO2+4HF
Si+2CO↑,F即CO,为不成盐氧化物。单质碳与什么氧化物反应生成CO和另一种单质呢?再从题中另一突破口入手:I是酸性物质,能与SiO2反应,就已学过的知识分析,SiO2是酸酐,与一般的酸不反应,唯独与HF反应:SiO2+4HF![]() SiF4↑+2H2O,则I是HF,其中F元素只能来自单质D(氟没有氧化物),则D为F2,HF中氢元素又只能来自氧化物C,C必为H2O。因为
SiF4↑+2H2O,则I是HF,其中F元素只能来自单质D(氟没有氧化物),则D为F2,HF中氢元素又只能来自氧化物C,C必为H2O。因为![]() 4HF+O2,所以单质H是O2,单质G是H2,一切问题迎刃而解。?
4HF+O2,所以单质H是O2,单质G是H2,一切问题迎刃而解。?
答案:(1)CO(一氧化碳)?
(2)SiO2?
(3)2H2+O2![]() 2H2O?
2H2O?
(4)![]() 4HF+O2
4HF+O2


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

 回答下列问题:
回答下列问题: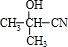
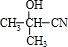


| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:
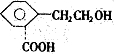
 A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图.已知:ROH+HX
A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图.已知:ROH+HX| △ |

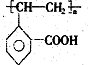
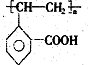
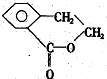




查看答案和解析>>
科目:高中化学 来源: 题型:
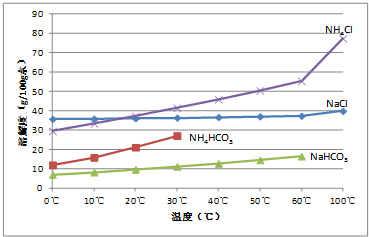
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
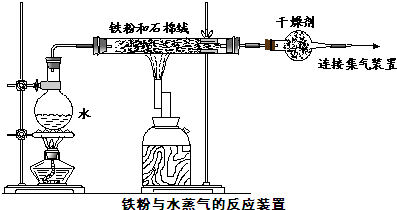
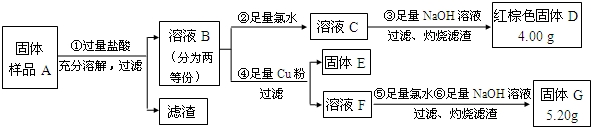
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com