

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可广泛可于太阳能电池 |
分析 己的最高价氧化物对应水化物有强脱水性,则为浓硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,甲、乙同主族且相邻,可知乙为Ca元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:己的最高价氧化物对应水化物有强脱水性,则为浓硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,可知乙为Ca元素,
A.丙与戊的原子序数相差为33-5=28,故A正确;
B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:庚>己>戊,故B错误;
C.金属性Ca>Mg,常温下,乙的单质能与水剧烈反应,而甲不能,故C错误;
D.丁的最高价氧化物SiO2可用于制造光导纤维,而Si处于用作半导体材料、太阳能电池,故D错误,
故选A.
点评 本题考查位置结构性质的关系及应用,把握信息及元素的位置推断元素为解答的关键,侧重分析推理能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化钠可用作漂白剂 | B. | 明矾可用作净水剂 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 氧化铝可用来制造耐火坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
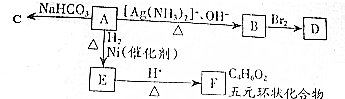
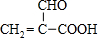
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
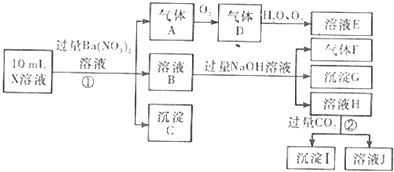
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| C. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| D. | 由热化学方程式H2(g)+F2(g)═2HF(g)△H=-270 kJ/mol可知2 L氟化氢气体分解成1 L的氢气和1 L的氟气吸收270 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于稀盐酸中 2Fe+6H+═2Fe3++H2↑ | |
| B. | 钠和水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1 FeCl3溶液中加入0.1 mol•L-1KI溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com