
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中发现有白色沉淀生成,继续滴加则沉淀溶解。丁溶液滴人甲溶液时,无明显现象产生。据此可推断丙物质是( )。
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)在一定温度下,有下列反应发生:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:
_____________________;
不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+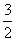 C(s)===
C(s)===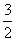 CO2(g)+2Fe(s)
CO2(g)+2Fe(s)
ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+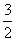 O2(g)===Fe2O3(s)的ΔH是____。
O2(g)===Fe2O3(s)的ΔH是____。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关四个常用电化学装置的叙述正确的是( )


A.图Ⅰ所示电池中,MnO2作催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,浓度都为1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,4 s后X2、Y2、Z的浓度分别是0. 4 mol·L-1,0.8 mol·L-1,0.4 mol·L-1,如Z用X、Y表示,则该反应式是( )
A.X2+2Y2 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2 2X2Y
2X2Y
C.3X2+Y2 2X3Y D.X2+3Y2
2X3Y D.X2+3Y2 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L,下列推断中不正确是( )。
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E 5种化合物中,其中A、B、C、D是铝元素的化合物,F是一种气体,在标准状况下对空气的相对密度是1.103,且有下列反应:
①A+NaOH—→D+H2O ②B—→A+H2O ③C+NaOH (适量)—→B+NaCl ④E+H2O—→NaOH+F ⑤C+D+H2O—→B
则A、B、C、D化学式分别是:A________、B________、C________、D________。
写出4 mol C和6 mol E在水溶液中发生反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一些烷烃的燃烧热如下表:
| 化合物 | 燃烧热/(kJ/mol) | 化合物 | 燃烧热/(kJ/mol) |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2—甲基丁烷 | 3 531.3 |
下列表达正确的是( )
A.正戊烷的燃烧热大约在3 540 kJ/mol左右
B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-1 560.8 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液的pH升高的原因是HCO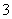 的水解程度增大,故碱性增强,该反应的离子方程式为__________________________。
的水解程度增大,故碱性增强,该反应的离子方程式为__________________________。
乙同学认为:溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度__________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)判断正确。试剂X是__________。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH__________(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言__________(填“甲”或“乙”)判断是错误的,理由是__________ _________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为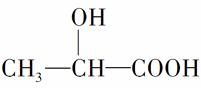 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:______、______。
(2)写出乳酸与足量金属钠反应的化学方程式:
_____________________________________________________。
(3)写出乳酸与碳酸钠溶液反应的化学方程式:
_____________________________________________________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com