
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
分析 (1)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大;
(2)碳酸氢钠是溶于水的盐,水溶液中全部电离为钠离子和碳酸氢根离子,属于强电解质,碳酸氢根离子水解溶液显碱性,常温下,0.1mol•L-1NaHCO3溶液的pH大于8溶液显碱性,说明碳酸氢根离子水解程度大于电离,据此比较离子浓度大小;
(3)开始沉淀时pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,根据Ksp计算OH-浓度;
(4)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH;
解答 解:(1)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选C;
故答案为:CO32-;C;
(2)碳酸氢钠是溶于水的盐,水溶液中全部电离为钠离子和碳酸氢根离子,属于强电解质,碳酸氢根离子水解溶液显碱性,HCO3-+H2O?H2CO3+OH-,c常温下,0.1mol•L-1NaHCO3溶液的pH大于8溶液显碱性,说明碳酸氢根离子水解程度大于电离,据此比较离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),
故答案为:强;HCO3-+H2O?H2CO3+OH-;c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
(3)pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=$\sqrt{\frac{2×1{0}^{-20}}{0.0002}}$=10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,溶液PH=6,
故答案为:Cu2+; 6;
(4)将适量FeS 投入H2S 饱和溶液中,c(Fe2+)达到1mol/L,溶液中c(S2-)=$\frac{Ksp}{c(F{e}^{2+})}$=$\frac{6.25×1{0}^{-18}}{1}$mol/L=6.25×10-18mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×1{0}^{-22}}{6.25×1{0}^{-18}}}$mol/L=4×10-3mol/L,pH=-lg4×10-3=2.4,
故答案为:2.4.
点评 本题考查了弱电解质的电离、盐的水解、离子浓度的比较、Ksp的应用等知识点,题目考查的知识点较多,题目难度中等,注意把握溶液中离子浓度大小比较的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①② | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
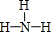 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是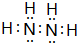 .
.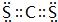 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子中C、H、O的个数之比为1:2:3 | B. | 分子中肯定不含氧原子 | ||
| C. | 分子中C和H的个数之比为1:2 | D. | 分子中可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
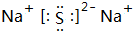 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可大量用于漂白食品 | B. | 干冰、AgI均可用于人工降雨 | ||
| C. | 四氧化三铁常用作红色油漆和涂料 | D. | 小苏打的主要成份是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.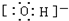 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 常温常压下,28g乙烯中含有碳碳双键数目为NA | |
| C. | 0.5mol•L-1K2SO4溶液中含有K+数目为NA | |
| D. | 28g铁与足量氯气反应失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ①③②④ | C. | ③②④① | D. | ③④①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com