
| A. | 84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒 | |
| B. | 输送氯气的管道漏气,可以用浓氨水检验,是因为氯气和氨气发生化合反应生成氯化铵. | |
| C. | 因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间 | |
| D. | 氯气和二氧化硫均有漂白性,二者按体积比1:1混合后不能是有色布条褪色 |
分析 A.NaClO和盐酸发生氧化还原反应生成氯气;
B.氯气和氨气发生氧化还原反应生成氯化铵和氮气;
C.氯水中含HClO,具有强氧化性,光照HClO分解生成氧气;
D.氯气和二氧化硫均有漂白性,二者按体积比1:1混合,反应生成硫酸和盐酸.
解答 解:A.NaClO和盐酸发生氧化还原反应生成氯气,则混合使用会产生氯气使人中毒,故A正确;
B.氯气和氨气发生氧化还原反应生成氯化铵和氮气,不是化合反应,故B错误;
C.氯水中含HClO,具有强氧化性,光照HClO分解生成氧气,则因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间,故C正确;
D.氯气和二氧化硫均有漂白性,二者按体积比1:1混合,反应生成硫酸和盐酸,则1:1混合后不能是有色布条褪色,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应及性质与用途的关系是解本题关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
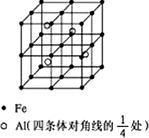 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
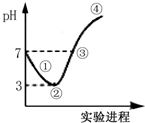 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m<n | C. | m=n | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com