
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
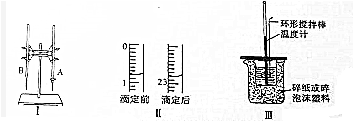
分析 (1)图Ⅰ所示用于酸碱中和滴定;图中A仪器是酸式滴定管;
(2)根据滴定管的结构以及测量体积的原理来分析;
(3)根据反应结束前溶液为无色,反应结束时溶液为浅红色判断滴定终点;
(4)等质量的NaOH和KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小;
(5)先判断数据的有效性,然后求出平均值,最后根据关系式K0H~HCl来计算出盐酸的浓度.
解答 解:(1)图Ⅰ所示实验名称是酸碱中和滴定;图中A仪器下端是玻璃塞,是酸式滴定管;
故答案为:酸碱中和滴定;酸式滴定管;
(2)滴定前读数为:0.80mL,滴定后读数为:22.80mL,消耗溶液的体积为22.00mL;
故答案为:22.00;
(3)①用标准K0H溶液测定某盐酸的浓度,反应结束前溶液为无色,滴定结束时溶液为浅红色,则滴定终点的现象为:溶液由无色变为浅红色,且半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)称取一定量的KOH固体(含少量NaOH),等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,造成V(标准)偏小,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,c(待测)偏低;
(5)三次滴定消耗标准液的体积分别为:22.02mL,24.00mL,21.98mL,第二次滴定数据误差过大,应该舍弃,其它两次消耗的标准液的平均体积为:
22.00mL
K0H~HCl
1 1
22.00mL×0.1000mol/L 20.0×C(HCl)
解得:C(HCl)=0.1100mol/L
故答案为:0.1100mol/L.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、仪器、误差以及注意事项,把握实验基本操作.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- | |
| C. | NaHCO3溶液中:K+、Na+、SO42-、Al3+ | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
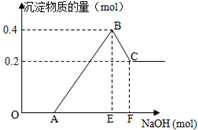 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,如图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
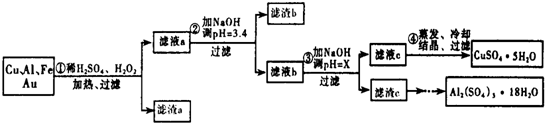
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com