
| A. | 0.3mol | B. | 0.15mol | C. | 0.1mol | D. | 0.075mol |
科目:高中化学 来源: 题型:选择题
| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 苏打粉--NaHCO3 | D. | 水煤气--CO、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发→云→降水,这是地球水循环的过程,该过程主要是物理变化 | |
| B. | 海水中所含的常量元素大部分以盐的形式存在,其中含量最高的盐是氯化钠 | |
| C. | 海洋是化学元素的集散地,元素周期表所有的元素在海水中都能找到 | |
| D. | 由海水制备镁、氯、溴、碘等单质均需要涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
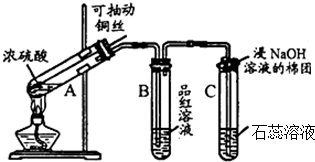
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 111 | B. | 112 | C. | 113 | D. | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com