
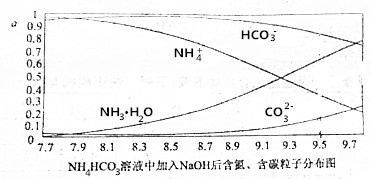
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
分析 NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O?HN3•H2O+H+①;
HCO3-的水解平衡,即HCO3-+H2O?H2CO3+OH-②;
HCO3-的电离平衡,即HCO3-?H++CO32-③;
在未加氢氧化钠时,溶液的PH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加;对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3•H2O的量增加,NH4+的量减小,当PH大于8.7以后,CO32-的量在增加,平衡③受到影响,据此分析.
解答 解:NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O?HN3•H2O+H+①;
HCO3-的水解平衡,即HCO3-+H2O?H2CO3+OH-②;
HCO3-的电离平衡,即HCO3-?H++CO32-③;
A.在未加氢氧化钠时,溶液的PH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;
B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3•H2O的量增加,NH4+被消耗,当PH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;
C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-),故C正确;
D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3•H2O,故D错误;
故选:D.
点评 本题结合图象考查了离子浓度大小比较、盐的水解原理等知识,明确图象曲线变化的含义为解答关键,注意用平衡移动理解各离子变化的原因,题目有一定难度.


科目:高中化学 来源: 题型:解答题
 太阳能电池的发展趋向于微型化、薄膜化.最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池.完成下列填空:
太阳能电池的发展趋向于微型化、薄膜化.最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素位于元素周期表中的同一周期 | |
| B. | X、Y、Z三种元素的原子半径依次减小 | |
| C. | X、Y、Z三种元素的原子序数大小为Y>Z>X | |
| D. | 若m>n.则Xm+的半径大于Zn+的半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
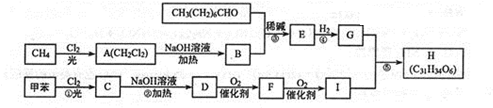
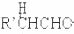 $\stackrel{稀碱}{→}$
$\stackrel{稀碱}{→}$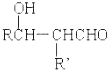
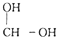 -OH$\stackrel{-H_{2}O}{→}$RCHO
-OH$\stackrel{-H_{2}O}{→}$RCHO .
. .
.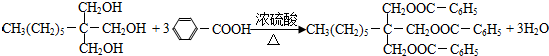 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
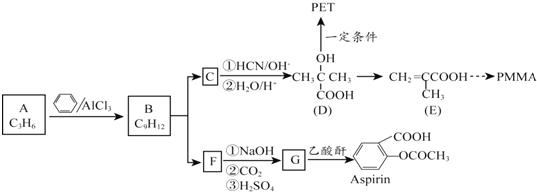
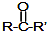 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$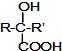
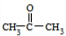 .
.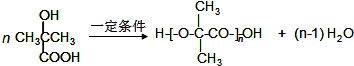 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com