
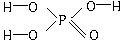
 ,其中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。
,其中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。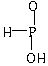 ,与过量NaOH溶液反应的化学方程式为H3PO2+NaOH=NaH2PO2+H2O。
,与过量NaOH溶液反应的化学方程式为H3PO2+NaOH=NaH2PO2+H2O。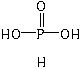 ,是二元酸。
,是二元酸。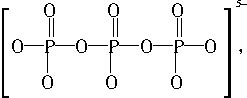 所以,1mol三聚磷酸钠中含有9molP―O键。
所以,1mol三聚磷酸钠中含有9molP―O键。 

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2011-2012学年河北省衡水中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(11分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:填空题
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为 20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:填空题
(11分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是 (填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是 (填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是 (填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是 (填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com