
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1知,浓硫酸与氢氧化钠反应生成l mol H2O放出57.3KJ的热量 | |
| B. | 氯气和氨气的水溶液都能导电,所以它们是电解质 | |
| C. | 将纯水的温度由25℃升高至100℃,水的离子积将变大,pH也升高,此时呈现中性 | |
| D. | 除去MgCl2溶液中少量的FeCl3,可以加入MgO,然后过滤 |
分析 A、浓硫酸和碱反应之前先是稀释,稀释过程放出大量的热,据此回答;
B、氯气属于单质,不属于电解质的范畴,氨气的水溶液导电不是氨气本身导电;
C、水的电离是吸热的过程,水的离子积受温度的影响,据此回答;
D、根据影响铁离子水解的因素结合除杂的原则来回答.
解答 解:A、浓硫酸和碱反应之前先是稀释,稀释过程放出大量的热,浓硫酸与氢氧化钠反应生成l mol H2O放出大于57.3KJ 的热量,故A错误;
B、氯气属于单质,不属于电解质的范畴,氨气的水溶液导电不是氨气本身导电,氨气属于非电解质,故B错误;
C、水的电离是吸热的过程,纯水的温度由25℃升高至100℃,水的离子积将变大,氢离子浓度增大,pH降低,此时呈现中性,故C错误;
D、铁离子水解生成氢氧化铁和盐酸,除去MgCl2溶液中少量的FeCl3,可以加入MgO,促使氯化铁的水解平衡正向移动,铁离子形成氢氧化铁沉淀而除去,故D正确.
故选D.
点评 本题涉及中和反应的热效应、电解质的概念、水的电离平衡移动以及盐的水解原理的应用等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题
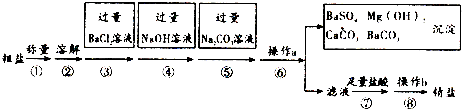
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③① | B. | ②④①③ | C. | ②①④③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T、Q与 T形成的化合物性质相似 | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I | Ii | Iii | |
| 备选装置 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 反应时间(min)及体系中A的浓度(mol/L) | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中溶有乙酸(浓硫酸,分液) | B. | 甲烷中含有乙烯(溴水,洗气) | ||
| C. | 汽油与水的混合物(苯,过滤) | D. | 乙醇中含有水(金属钠,蒸馏) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com