
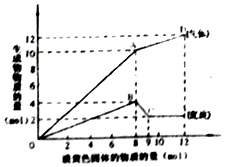
 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
分析 淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为2mol,氢氧化铝为4mol-2mol=2mol,根据元素守恒计算Al3+、Mg2+物质的量,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,据此进行分析.
解答 解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,
A.淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+,Al3+,Mg2+,故A错误;
B.由上述分析可知,A点产生的气体是NH3和O2,根据元素守恒n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol,当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×$\frac{1}{2}$=4mol,所以n(NH4+)=n(NH3)=10mol-n(O2)=6mol,故m=m(O2)+m(NH3)=4mol×32g/mol+6mol×17g/mol=230g,故B正确;
C.加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,故A到D之间会产生有刺激性气味的气体,不是氨气,故C错误;
D.B到C之间发生的反应为Al(OH)3+OH-=AlO2-+2H2O,无元素价态发生变化,故不是氧化还原反应,故D错误;
故选B.
点评 本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会生成氨气逸出.


科目:高中化学 来源: 题型:选择题
| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 土壤污染--科学灌溉,合理使用农药和化肥 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
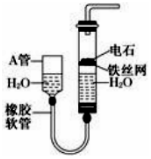 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
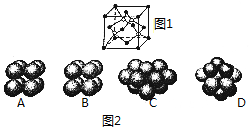 (1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同
(1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:
太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的简单二元化合物的电子式为 | |
| B. | 短周期元素中Y的原子半径最大 | |
| C. | 工业上通过电解Y的氧化物制取Y的单质 | |
| D. | 最外层电子数等于其电子层数的金属与Z形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ 1s22s22p63s23p6 | B. | F 1s22s22p5 | ||
| C. | S2- 1s22s22p63s23p4 | D. | Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖与纤维素均属于高分子化合物 | |
| B. | 不同的油脂发生皂化反应,至少有一种产物相同 | |
| C. | 淀粉在稀硫酸作用下充分加热后,所得溶液与少量新制Cu(OH)2共热未见红色沉淀,说明淀粉未发生水解 | |
| D. | 蛋白质溶液中加入酒精后会发生盐析而失去生理活性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com