
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
| ||
| ||
| ||
| ||


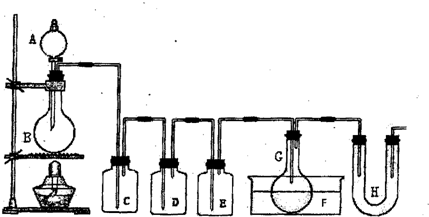
科目:高中化学 来源:2011届上海市静安区高三4月教学质量调研化学试卷 题型:实验题
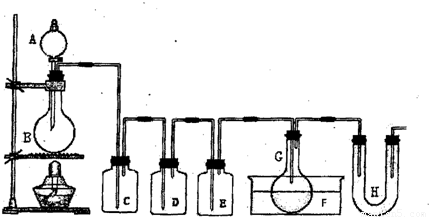
用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
| | 熔点 | 沸点 |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
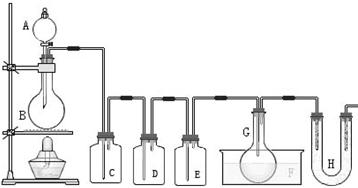
 ,则F中盛有 ,作用是______________________。
,则F中盛有 ,作用是______________________。查看答案和解析>>
科目:高中化学 来源:2010-2011学年天津市高三第二次模拟考试(理综)化学部分 题型:实验题
(18分)用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下:
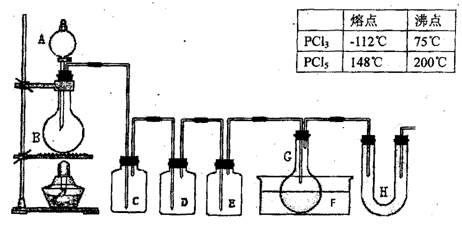
请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是 。
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,发生反应的化学方程式为 。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是 ;从PCl3和PCl5的混合物中分离也PCl3的最佳方法是 (选填序号)。
a.蒸馏 b.分液 c.升华
(5)生成的PCl3在G中收集,则F中盛有 ,作用是
(6)C、D、H所盛的试剂分别是:C ;D ;H 。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014届天津市高一上学期期末考试化学试卷 题型:实验题
(14分)用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75OC)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下:
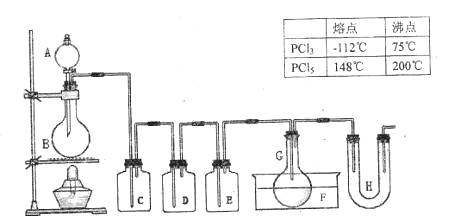
请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,发生反应的化学方程式为 。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是 ;
从PCl3和PCl5的混合物中分离出PCl3的最佳方法是 (选填序号)。
a、蒸馏 b、分液 c、升华
(5)生成的PCl3在G中收集,则F中盛有 , 作用是
(6)C、D、H所盛的试剂分别是:C ;D ;H 。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2011年天津市耀华中学高考化学二模试卷(解析版) 题型:填空题
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com