
| c |
| 2 |
| 3c |
| 2 |
| c |
| 2 |
| 3c |
| 2 |
| △c |
| △t |
| m |
| n |
| m |
| V |
| ||
| 5min |
| c |
| 2 |
| 3c |
| 2 |
| c |
| 2 |
| 3c |
| 2 |
| c |
| 2 |
| 3c |
| 2 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(2013?广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: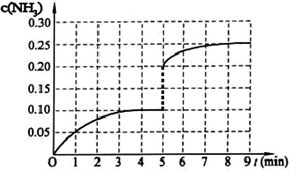

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分))氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=2 NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H = - 746 kJ • mol-1
则反应CO(g) +![]() O2(g) = CO2(g)的△H = kJ• mol-1
O2(g) = CO2(g)的△H = kJ• mol-1
(3)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g)![]() 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com