
| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
分析 反应MnO2+4HCl(浓)═MnCl2↑+Cl2↑+2H2O中,HCl中-1价氯原子被氧化成氯气,根据Cl元素质量守恒可计算出生成氯气的物质的量,然后根据m=nM计算出生成氯气的质量.
解答 解:氧化还原反应MnO2+4HCl(浓)═MnCl2↑+Cl2↑+2H2O,HCl被氧化生成氯气,7.gHCl的物质的量为:$\frac{7.3g}{36.5g/mol}$=0.2mol,
根据Cl元素守恒可知生成氯气的物质的量为:n(Cl2)=$\frac{1}{2}$×0.2mol=0.1mol,
所以生成Cl2的质量为71g/mol×0.1mol=7.1g,
故选D.
点评 本题考查了化学方程式的计算,题目难度不大,明确氧化还原反应的特征为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
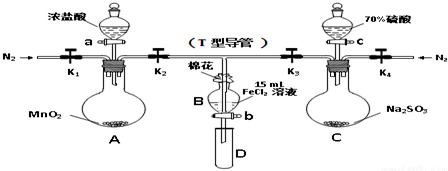
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化不一定都是化学反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
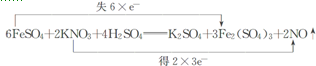 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于制漂白粉 | B. | 液氨可用作制冷剂 | ||
| C. | 活性炭可以去除冰箱中的异味 | D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纳米管中的镓为液体 | |
| B. | 金属镓的体积在10℃~500℃之间随温度的变化比较均匀 | |
| C. | 碳纳米管的体积在10℃~500℃之间随温度的变化很小 | |
| D. | Al(OH)3、Ga(OH)3均是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com