
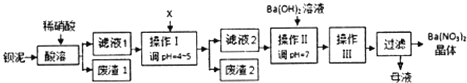
分析 钡泥中主要含有BaCO3、BaSO3、Ba(Fe O2)2等,加稀硝酸溶解,BaSO3被氧化为BaSO4,过滤,滤渣为BaSO4,滤液中主要含有Ba2+、H+、Fe3+,调节pH,使Fe3+转化为氢氧化铁沉淀除去,过滤,滤渣2为氢氧化铁,滤液2中主要含有Ba2+、H+,加氢氧化钡溶液中和多余的氢离子,使溶液为中性,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硝酸钡晶体;
(1)酸溶时,碳酸钡与氢离子反应生成二氧化碳、钡离子和水;
(2)加稀硝酸溶解,Ba(Fe O2)2转化为Ba2+、Fe3+;
(3)调节pH除去铁离子;
(4)当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化;
(5)根据Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9,求出化学平衡常数,结合化学方程式进行计算;
(6)根据从溶液中提取溶质的操作分析;
(7)硝酸与亚硫酸钡反应的产物之一为氮的氧化物,钡离子属于有毒的重金属离子,根据氮的氧化物和钡离子对环境的影响分析.
解答 解:钡泥中主要含有BaCO3、BaSO3、Ba(Fe O2)2等,加稀硝酸溶解,BaSO3被氧化为BaSO4,过滤,滤渣为BaSO4,滤液中主要含有Ba2+、H+、Fe3+,调节pH,使Fe3+转化为氢氧化铁沉淀除去,过滤,滤渣2为氢氧化铁,滤液2中主要含有Ba2+、H+,加氢氧化钡溶液中和多余的氢离子,使溶液为中性,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硝酸钡晶体;
(1)酸溶时,碳酸钡与氢离子反应生成二氧化碳、钡离子和水,其反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O;
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(2)加稀硝酸溶解,Ba(Fe O2)2转化为Ba2+、Fe3+,另外溶液中还含有多余的氢离子,所以溶液中的阳离子有Ba2+、Fe3+、H+;
故答案为:H+、Fe3+;
(3)溶液中含有杂质离子Fe3+,调节溶液的pHFe3+会转化为氢氧化铁沉淀,然后过滤除去;
故答案为:调节溶液的pH,使Fe3+完全沉淀除去;
(4)溶液存在BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq),当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
故答案为:BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq);
(5)BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq)的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{5.1×1{0}^{-9}}$=0.0216,
设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.02.0-x)mol•L-1 x mol•L-1
根据K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{x}{2.0-x}$=0.0216
解得:x=0.0441,处理次数=$\frac{0.21mol}{0.0441mol}$=4.76,所以至少处理5次,
故答案为:5;
(6)从溶液中提取溶质经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到硝酸钡晶体;
故答案为:蒸发浓缩;过滤;
(7)硝酸与亚硫酸钡反应的产物之一为氮的氧化物,氮的氧化物属于有毒气体,会污染空气,钡离子属于有毒的重金属离子,最后的母液中含有钡离子,会污染环境,因此要进一步处理,避免造成二次污染;
故答案为:氮的氧化物和重金属污染.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
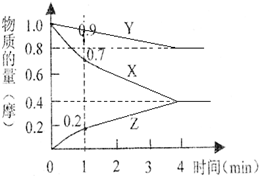 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 红外光谱图的研究可以确定有机物的相对分子质量 | |
| C. | 测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的 | |
| D. | 铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | CO32- | C. | HCO3- | D. | AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
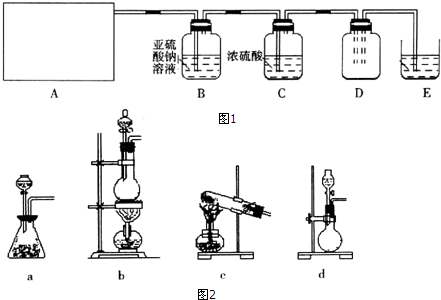
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | 能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 | |
| C. | 将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 | |
| D. | 用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com