
【题目】在①FeCl3溶液、②Fe(OH)3悬浊液和③Fe(OH)3胶体3种分散系中,分散质粒子的直径由大到小的顺序是 . (用序号填写)
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. CO32-、OH-、Na+、H+B. Al3+、Na+、S2-、Cl-
C. Cl-、H+、SO42-、Cu2+D. Ba2+、HCO3-、K+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①NaCl和NaNO3②CaCO3和BaCl2③KCl和MnO2④BaSO4和AgCl按溶解、过滤、蒸发的操作顺序能将它们一一分离的是( )
A.只有①
B.③和④
C.②和③
D.只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述中,错误的是( )
A. 氧化铝可用于制造耐火坩埚B. 二氧化硫可用来漂白食品
C. 氧化铁可用作红色油漆和涂料D. 硅酸钠溶液可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于1 mol H2O的下列说法中,错误的是(NA表示阿伏加德罗常数的值)( )
A. 质量为18 gB. 标准状况下的体积为22.4 L
C. 含电子数为10NAD. 含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《侏罗纪公园》中,霸王龙被描述成株罗纪最凶猛的食肉动物。下列关于其体内的化学元素与人体内的化学元素的说法中,最可能不正确的是( )
A.含量相同B.种类相同C.具有统一性D.具有差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
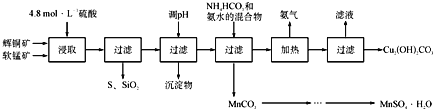
已知:
①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③MnSO4·H2O易溶于冷水,不溶于酒精;
④部分金属阳离子氢氧化物的(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算:当离子浓度小于1.0×10-5时,认为该离子沉淀完全。):
Ksp(Fe(OH)3)=1.0×10-38, Ksp(Cu(OH)2)=1.0×10-20, Ksp(Mn(OH)2)=4.0×10-14
(1)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式_________________________________。
(2)调pH的范围为____________。
(3)在该工艺中可循环使用的物质是______________;“加热驱氨” 环节,温度不能过低也不能过高的原因为___。
(4)请根据如下图示,将“由碳酸锰经一系列操作获得MnSO4·H2O晶体,并测定纯度”的实验方案补充完整。
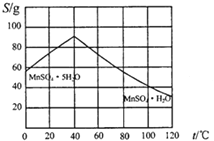
①将碳酸锰固体溶于稀硫酸获得硫酸锰溶液;
②加热溶液并控制温度>40℃,_________得到粗产品;
③_______,低温干燥,可得到较纯晶体。
④欲测定该品体的纯度,取14.00g晶体加蒸馏水配成100mL溶液,量取25.00mL,加足量标准BaCl2溶液,得到沉淀4.66g,则此样品的纯度为___(保留四位有效数字)。某小组计算发现本组样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有__(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
【答案】 碱性 > 酸性 < 中性 > < m>n
【解析】本题主要考查弱酸电离及其盐类水解。
(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,形成醋酸钠溶液,醋酸钠水解使溶液呈碱性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且碱性溶液中,[H+]<[OH-],所以[Na+]>[CH3COO-]。
(2)醋酸难电离,常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,由于醋酸浓度较大而剩余,醋酸电离使溶液呈酸性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且酸性溶液中,[H+]>[OH-],所以[Na+]<[CH3COO-]。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],由于溶液中醋酸根离子和钠离子浓度相等,所以[H+]=[OH-],则混合后溶液呈中性,与(1)比较可知醋酸溶液的体积>氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸难电离,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-),与(1)比较可知m与n的大小关系式为m>n。
【题型】填空题
【结束】
23
【题目】某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
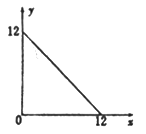
(1)此温度下,水的离子积KW=______________,则该温度T________25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=________, 实验②中由水电离产生的[OH-]=______mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显__________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com