解:A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;判断A为氮元素;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,说明最高氧化为对应水化物是酸、碱、两性氢氧化物,短周期中为氢氧化钠、氢氧化铝、A、B、C、D四种短周期元素的原子序数依次增大,B和D可组成化合物BD,则B为钠元素,C为铝元素,D为氯元素,
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为氢氧化钠和氢氧化铝反应,C最高价氧化物对应的水化物为Al(OH)
3,属于两性氢氧化物,与D对应的强碱NaOH反应生成,反应的离子方程式为Al(OH)
3+OH
-=AlO
2-+2H
2O;故答案为:Al(OH)
3+OH
-=AlO
2-+2H
2O;
(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,氢氧化钠和D对应的最高价氧化物对应水化物为HClO
4反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为:
NaOH(aq)+HClO4(aq)=NaClO4(aq)+H
2O(l)△H=-4QKJ/mol,
故答案为:NaOH(aq)+HClO4(aq)=NaClO4(aq)+H
2O(l)△H=-4QKJ/mol;
(3)在BHCO
3的水溶液中是NaHCO
3,依据物料守恒得到:c(Na
+)=c(H
2CO
3)+C(HCO
3-)+C(CO
32-),所以得到c(Na
+)-c(H
2CO
3)=C(HCO
3-)+C(CO
32-),故答案为:c(Na
+)-c(H
2CO
3)=C(HCO
3-)+C(CO
32-);
(4)在一定条件下,将2molN
2和3molH
2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,依据化学平衡三段式列式计算:设反应氢气物质的量为x
N
2+3H
2=2NH
3
起始量(mol) 2 3 0
变化量(mol) x 3x 2x
平衡量(mol) 2-x 3-3x 2x
混合气体的平均相对分子质量为15.5,可知15.5=
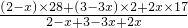
,x=0.5mol,
氢气转化率=
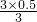
×100%=50%
若平衡后,n(N
2)=1.5mol:n(H
2)=1.5mol:n(NH
3)=1mol;再按n(N
2):n(H
2):n(NH
3)=3:3:2向该密闭容器中充入气体,相当于加入了平衡体系.增大容器中的压强,平衡正向移动,当重新达到平衡后,N
2在平衡混合气中的百分含量较原平衡减少;故答案为:小.
分析:A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;NH
3+HNO
3=NH
4NO
3,判断A为氮元素;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,说明最高氧化为对应水化物是酸、碱、两性氢氧化物,短周期中为氢氧化钠、氢氧化铝、A、B、C、D四种短周期元素的原子序数依次增大,B和D可组成化合物BD,则B为钠元素,C为铝元素,D为氯元素.
点评:本题考查元素的推断以及元素化合物知识,题目难度中等,本题中注意侧重于物质的性质的推断角度,学习中注意把握常见元素化合物的性质.

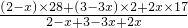 ,x=0.5mol,
,x=0.5mol,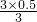 ×100%=50%
×100%=50%



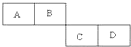 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.