
 2SO3(g)����ƽ��ʱ����й��������±���
2SO3(g)����ƽ��ʱ����й��������±���| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 2 mol SO2��1 mol O2 | 4 mol SO3 |
| n(SO3)/mol | 1.6 | a |
| ��Ӧ���ת���� | ��1 | ��2 |
 2SO3(g)
2SO3(g) 2SO2(g)��O2(g)
2SO2(g)��O2(g)

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
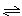 2Y��g��+Z��g������YŨ����0.048mol��L��1���ӵ�0.12 mol��L��1��18s����ô����0.12mol��L��1���ӵ�0.2mol��L��1����Ҫ��Ӧ��ʱ����
2Y��g��+Z��g������YŨ����0.048mol��L��1���ӵ�0.12 mol��L��1��18s����ô����0.12mol��L��1���ӵ�0.2mol��L��1����Ҫ��Ӧ��ʱ����| A������20s | B������18s | C������20s | D������ 18s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������¶ȣ���Ч��ײ�������� |
| B��������Ч��ײʱ����һ��������ѧ��Ӧ |
| C�������֮�䷢������ײһ��Ϊ��Ч��ײ |
| D����������������������䣬��Ч��ײ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.04 | B��0.04mol / (L.s) | C��0.08mol(L.s) | D��0.04mol / L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����H<0��
2SO3(g)����H<0��
| A��ͼI�о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
| B��ͼII�о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ�� |
| C��ͼIII�о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ� |
| D��ͼIII�о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
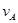 ��
��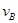 ��
��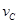 ��ʾ����֪2
��ʾ����֪2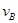 =3
=3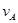 ��3
��3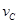 =2
=2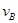 ����˷�Ӧ�ɱ�ʾΪ �� ��
����˷�Ӧ�ɱ�ʾΪ �� ��| A��3A+B=2C | B��A+3B=2C | C��2A+3B="2C" | D��A+B=C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.32 mol/(L��s)�������� | B��0.16 mol/(L��s) |
| C��1.6 mol/(L��s) | D��0.8 mol/(L��s) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO2��g������N2O4��Ũ����0.1 mol�� L-1����0.07 mol�� L-1��Ҫ15 s����ôN2O4��Ũ����0.07 mol��L-1����0.05 mol��L-1���跴Ӧ��ʱ�䣨 ��
2NO2��g������N2O4��Ũ����0.1 mol�� L-1����0.07 mol�� L-1��Ҫ15 s����ôN2O4��Ũ����0.07 mol��L-1����0.05 mol��L-1���跴Ӧ��ʱ�䣨 ��| A������10 s | B������10 s | C������5 s | D��С��10 s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C+4D�ķ�Ӧ�У������ò�ͬ���ʵı仯��ʾ�÷�Ӧ������������
3C+4D�ķ�Ӧ�У������ò�ͬ���ʵı仯��ʾ�÷�Ӧ�������������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com