

| A. | 酸碱中和反应是放热反应 | |
| B. | 图1所示的反应为吸热反应 | |
| C. | 图2装置中铜片是负极,锌片表面有气泡出现 | |
| D. | 图2装置是将电能转变为化学能的装置 |
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
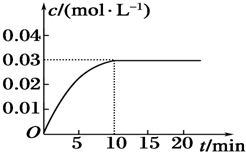
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
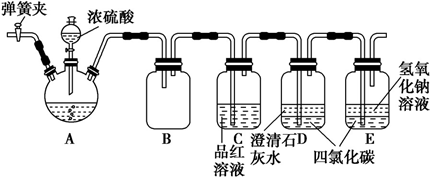
科目:高中化学 来源: 题型:实验题
| 实验序号 | 金属质量 | 金属状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验不需要指示剂 | |
| B. | 用量筒量取上述硫酸的体积 | |
| C. | H2SO4的浓度为1.00 mol•L-1 | |
| D. | 参加反应的H+和OH-的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 | |
| B. | 1 mol A(强酸)与1 mol B(强碱)发生中和反应所放出的热量叫做中和热 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用CaCO3固体与稀盐酸制取CO2,多倒出的CaCO3固体不能再放回原试剂瓶 | |
| B. | H2还原灼热的氧化铜时,点燃酒精灯前必须先检验H2的纯度 | |
| C. | 含硫酸铜的废液倒入水槽,用水冲入下水道 | |
| D. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com