
【题目】有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应是加成反应,下列过程与加成反应无关的是( )
A.甲烷与氯气的混合气体在光照条件下颜色变浅
B.乙烯与溴水混合振荡,水层颜色褪去
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
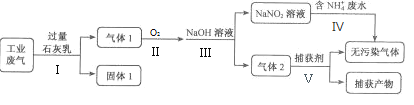
已知::2NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+H2O。
(1)固体1的主要成分除Ca(OH)2外,还有__________ 、________ (填化学式);
(2)步骤Ⅱ中需要的O2量应是_____(填“少量”或“过量”);步骤Ⅴ最终捕获剂捕获的气体产物是________;
(3)步骤Ⅳ处理含NH4+废水时,发生反应的离子方程式为__________________;
(4)为确保步骤Ⅲ无NaNO3生成,理论上应控制NO与O2的物质的量之比为_____,若n(NO) :n(O2)=5:2且NaOH溶液足量,则步骤Ⅲ所得溶液中NaNO3与NaNO2的物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2.50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。
(1)写出盐酸与大理石反应的化学方程式________
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究______对反应速率的影响 |
② | __ | 粗颗粒 | 2.50 | |
③ | 25 | 粗颗粒 | ___ | |
④ | 25 | 细颗粒 | 2.50 |
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 ______(忽略溶液体积变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的化学电源在日常生活和高科技领域中都有广泛应用,有关以上化学电源说法错误的是( )
A. 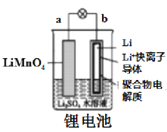 图中:放电时,溶液中Li+从a向b迁移
图中:放电时,溶液中Li+从a向b迁移
B. 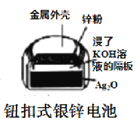 图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C. 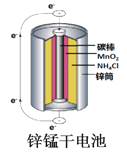 图中:锌筒作负极,发生氧化反应,锌筒会变薄
图中:锌筒作负极,发生氧化反应,锌筒会变薄
D. 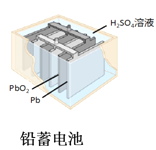 图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO和Fe2O3的混合物中加入150 mL一定浓度的稀硝酸恰好使混合物完全溶解,同时可得到标准状况下1.12 L NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现。若用足量的CO在加热条件下还原相同质量的混合物得到11.2 g铁单质。下列说法正确的是( )
A. 往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+
B. 原稀硝酸的物质的量浓度为3mol/L
C. 能确定铁和三氧化二铁的物质的量之比
D. 混合物中铁单质为0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
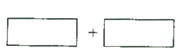
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
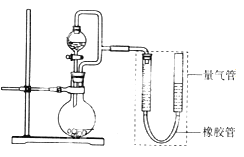
(实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
(实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组研究混有少量氯化钠杂质的纯碱样品,设计如下装置来测定该纯碱样品的纯度。实验步骤如下:
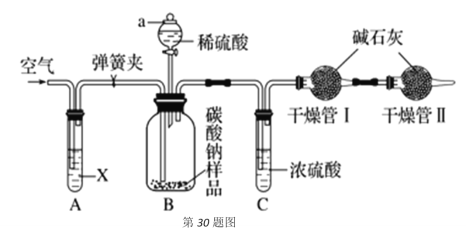
①组装好仪器并检查气密性;
②用托盘天平称量干燥管Ⅰ的质量为m1;
③称量纯碱样品的质量为n,装入广口瓶B内;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤往试管A缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的质量为m2。
请回答:
(1)试剂X是__________,写出广口瓶B中反应的化学方程式__________。
(2)干燥管Ⅱ的作用是__________。
(3)步骤④若滴入稀硫酸过快,会导致测定结果__________(填“偏大”、“偏小”或者“不变”);理由是__________。
(4)根据此实验,计算纯碱样品纯度的为__________(用含m1、m2、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com