

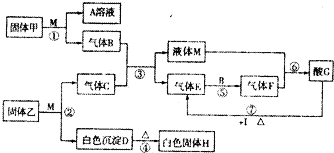
2A(?)+B(?)![]() xC(g)����H��0
xC(g)����H��0
ƽ��ʱA��B��C�����ʵ���֮��Ϊ1��3��4��C�����ʵ���Ϊy mol�������ڵ�ѹǿΪP1��
(1)�����������ݼ��㣬x=___________��y=___________��
(2)��ͼ�����¶Ȳ��䣬�����ҲΪV L�ĺ����ܱ������з���������Ӧ����÷�Ӧ�����������ƽ����Է���������ʱ��ı仯��ͼ����ʾ��ƽ��ʱ������C�����ʵ���Ϊz mol,�����ڵ�ѹǿΪP2��

����A��B��Ϊ��̬����P1��P2����Դ�СΪP1________P2(�������=������)��
���뽫������������п������η��բ������±�(�ɲ�����)��
���ܵ����� | A��B�Ƿ�Ϊ��̬ | z��y����Դ�С | |
�� | A | B | z=y |
�� | �� | ���� |
|
�� |
|
|
|
�� |
|
|
|
 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
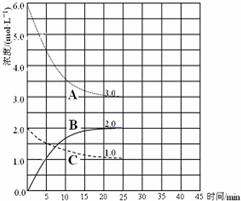 �ϳɰ���ũҵ���������������������Ҫ���壮��֪��N2��g��+3H2��g��?2NH3��g����H=-92kJ?mol-1��ͼ���ں��º����ܱ������н��кϳɰ���Ӧ��ͼ��
�ϳɰ���ũҵ���������������������Ҫ���壮��֪��N2��g��+3H2��g��?2NH3��g����H=-92kJ?mol-1��ͼ���ں��º����ܱ������н��кϳɰ���Ӧ��ͼ��| A��ǰ25min�ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧƽ��������0.04 mol?L-1?min-1 | B����25min ĩ��Ӧ�պôﵽƽ�⣬����¶��·�Ӧ��ƽ�ⳣ��K=0.148 | C���÷�Ӧ�ﵽƽ��ʱ�ų�����Ϊ92kJ | D��V����N2��=2V����NH3��˵������ƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���㽭ʡ��У������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں��º�ѹ�ܱ�����M����ͼ�ͺ��º����ܱ�����N����ͼ���У��������о�����a molA��a molB����ʼʱ�����������ΪVL���������·�Ӧ���ﵽ��ѧƽ��״̬��2A��?��+ B��?�� xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��
xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��

A��x��2
B����N��������ܶ���ͼ����ʾ����A��Bֻ��һ������̬
C��AΪ���壬BΪ�����壬��ƽ��ʱM��N��C�����ʵ������
D����A��B��Ϊ���壬ƽ��ʱM��A��ת����С��N��A��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ������ʮУ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��800��ʱ�����ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO��H2Oά�ֺ��£�������ӦCO(g)+H2O(g) H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
|
��Ӧʱ��/min |
0 |
2 |
4 |
6 |
|
n(CO)/mol |
1.20 |
0.90 |
|
0.80 |
|
n(H2O)/ mol |
0.60 |
|
0.20 |
|
�ٷ�Ӧ��2 min�ڵ�ƽ������Ϊv(H2O)��___________��
��800��ʱ����ѧƽ�ⳣ��K��ֵΪ_______________��
�۱��������������䣬��ƽ����ϵ����ͨ��0.20 mol H2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת����______�������С�����䡱����
���ں��º�ѹ�ܱ�������ͨ��CO��H2O��1 mol�����÷�Ӧ������Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1ʱ��ͨ���1 mol��CO��H2O�Ļ�����壬������ͼ�л�����(v��)����(v��)��Ӧ������t1����ʱ��t�仯������ͼ��

��.ʵ���������ø��ֽⷴӦ��ȡMg(OH)2��ʵ�����ݺ��������±���ʾ����Һ�����ȡ��1mL����
|
��� |
ҩƷ1 |
ҩƷ2 |
ʵ������ |
|
I |
0.01 mol/L NaOH��Һ |
0.01 mol/L MgCl2��Һ |
���ɰ�ɫ���� |
|
II |
0.01 mol/L��ˮ |
0.01 mol/L MgCl2��Һ |
������ |
|
III |
0.1 mol/L��ˮ |
0.1 mol/L MgCl2��Һ |
����III |
|
IV |
0.1 mol/L��ˮ |
0.01 mol/L MgCl2��Һ |
���ɰ�ɫ���� |
|
V |
0.01 mol/L��ˮ |
0.1 mol/L MgCl2��Һ |
������ |
������III�� ��
�������0.028 mol/L��MgCl2��Һ�м���������NaOH��Һ�������NaOH��Һ��Ũ�����ٴﵽ
mol/Lʱ����Һ�п�ʼ���ְ�ɫ������Ksp(Mg(OH)2)= 5.6��10-12����
��MgCl2��Һ�Ͱ�ˮ��Ϻ�������л�ѧƽ�⣺Mg2+(aq)
+ 2NH3��H2O(aq) 2NH4+(aq)
+ Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK=
���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ
��
2NH4+(aq)
+ Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK=
���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com