
| A. | 12、2.5 | B. | 24、2.5 | C. | 12、3 | D. | 24、3 |
分析 反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N、S元素的化合价降低,C元素的化合价升高,依据氧化剂与还原剂得失电子数守恒计算2mol KNO3可氧化的C的物质的量.
解答 解:在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,C由0价升高为+4价,做还原剂,根据反应可知,3molC完全被氧化化合价升高:3mol×4=12mol;
2mol KNO3得到电子为:2mol×5=10mol,设能够氧化碳的物质的量为xmol,则依据得失电子守恒得:10mol=x×4,解得:x=2.5,氧化产物b=2.5,
故选A.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质与特征为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
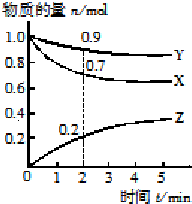 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA | |
| B. | 6.4gCu与过量硫粉反应,转移电子数为0.2NA | |
| C. | 通常状况下,112mL水中含有的电子数约为62.2NA | |
| D. | 标况下,2.24LSO3中含有0.1NA个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Fe3+的溶液中:Na+,SCN-,SO42-,NO3- | |
| B. | 在pH=1的溶液中:Fe3+,Mg2+,Cl-,SO42- | |
| C. | 在加入了FeSO4•7H2O晶体溶液中:Na+,H+,Cl-,NO3- | |
| D. | 能使紫色石蕊试液变红的溶液中:K+,HCO3-,NO3-,S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
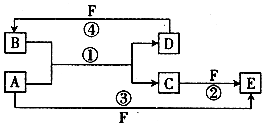 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 将铁棒和石墨用导线连接后插入含有Fe2+、Cu2+的盐溶液中 | 探究Fe2+和Cu2+的氧化性相对强弱 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
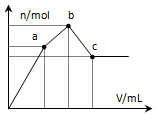 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com