
已知:25℃时,有关弱酸的电离平衡常数,下列选项中正确的是
弱酸 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数Ki | Ki1=5.9×l0-2 Ki2=6.4×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1=4.3×l0-7 Ki2=5.6×l0-11 |
A.等物质的量浓度的溶液pH关系:NaHCO3>NaCN>CH3COONa>NaHC2O4
B.反应NaHC2O4+NaHCO3→Na2C2O4+H2O+CO2↑能发生
C.等体积等物质的量浓度的溶液中离子总数:NaCN>CH3COONa
D.Na2CO3溶液中2c(Na+)=c(CO32-)+c(HCO3-)+c( H2CO3)
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.1.01×105 Pa、25 ℃时,2.24 L Cl2中含有的原子数为0.2×6.02×1023
B.0.1 L 3 mol·L-1 NH4NO3溶液中含有的N原子数目为0.3×6.02×1023
C.5.6 g铁粉与足量CuSO4溶液反应生成的铜原子数为1×6.02×1023
D.46 g NO2和N2O4的混合物中含有的原子数为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江双鸭山一中高二上期中化学卷(解析版) 题型:选择题
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2-.据此判断,以下叙述错误的是
NH4++NH2-.据此判断,以下叙述错误的是
A.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
B.液氨中含有NH3、NH4+、NH2-等粒子
C.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
D.液 氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高二上11月月考化学卷(解析版) 题型:填空题
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)某温度时,Kw=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈 性。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据上表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度 。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因 (写离子方程式并用必要的文字说明)。
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高二上11月月考化学卷(解析版) 题型:选择题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,该法的工艺流程为:
CrO42-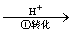 Cr2O72-
Cr2O72-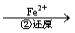 Cr3+
Cr3+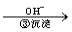 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。下列有关说法正确的是
Cr2O72-(橙色)+H2O。下列有关说法正确的是
A.第①步当2v(Cr2O72)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于 CrO42-的生成
C.第②步中,还原 0.1molCr2O72-需要45.6gFeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高二上11月月考化学卷(解析版) 题型:选择题
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.在Na2S溶液中加入AgCl固体,溶液中c(S2-)浓度减小
C.N2(g)+3H2(g)=2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:填空题
Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ⑧⑨ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________(填序号)。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移的电子的物质的量为___________mol。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________ _________+ ________+H2O
_________+ ________+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
NA代表阿伏伽德罗常数,下列说法中正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.在标准状况下,22.4L水中所含的分子数为
C.在常温常压下,11.2L氮气所含的原子数是NA
D.34g氨气所含质子数目为20NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上11月月考化学卷(解析版) 题型:选择题
有关①100mL 0.1mol/LNaHCO3、②100mL 0.1mol/LNa2CO3两种溶液的叙述不正确的是
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3)
D.②溶液中:c(HCO3-)>c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com