
分析 (1)浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)①容量瓶瓶颈较细,移液时需要用玻璃棒引流;定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析;
②从洗涤液不倒入容量瓶能否产生误差进行分析;
③依据定容的正确操作解答;
④错误操作导致实验失败且无法挽回的必须重新配制;
(3)根据量筒的作用、将水加入硫酸中有何危险分析.
解答 解:(1)98%的浓硫酸(密度为1.80g/ml)硫酸的物质的量浓度C=$\frac{1000×1.80×98%}{98}$=18mol/L,配制制85mL 3.6mol/L,应选择100mL容量瓶,依据溶液稀释过程中溶质的物质的量不变得:V×18mol/L=100mL×3.6mol/L,解得V=20.0mL;
故答案为:20.0mL;
(2)①若将玻璃棒插入容量瓶刻度线以上,会使少量溶液滞留在刻度线以上而导致定容时有偏差;由于容量瓶劲较细,为避免溶液洒在外面应用玻璃棒引流;
定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$,溶液浓度偏小;
故答案为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;偏小;
②洗涤液中含有部分溶质,不将洗涤液倒入容量瓶中,会导致溶液浓度降低,
故答案为:使溶质完全转移到容量瓶中;
③加水至离刻度线1~2cm时,用胶头滴管滴加水,容易控制水的体积,液面是凹形的,只有液面最低端与刻度线相切时,才是溶液的真实体积,否则,会造成浓度有偏差,
故答案为:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,无论采取A、B、C的何种方式都不能配置成需要的溶液,只能重新配制;
故答案为:D;
(3)量筒只能量取液体不能配置溶液,如果将水加入浓硫酸中会造成液体飞溅,
故答案为:不能用量筒配制溶液、不能将水加入到浓硫酸中.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理及正确的操作步骤是解题关键,注意容量瓶使用方法和注意事项,注意浓硫酸的稀释操作,题目难度中等.


科目:高中化学 来源: 题型:选择题
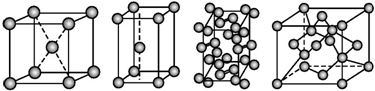
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
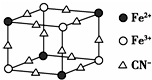
| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B与D形成的原子个数比为1:1的化合物乙的电子式是
,B与D形成的原子个数比为1:1的化合物乙的电子式是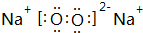 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Z->Y2- | B. | 原子半径:W>X>Y>Z | ||
| C. | 离子半径:Y2->Z->X+>W3+ | D. | 原子序数d>c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | Y与Q的氢化物相遇生成白烟 | |
| C. | 气态氢化物的还原性:W>X>Y | |
| D. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com