
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 .
(2)试通过计算确定该结晶水合物的化学式.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol•L﹣1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
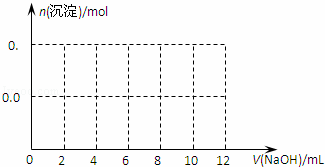
考点: 复杂化学式的确定;无机物的推断.
专题: 推断题;计算题.
分析: (1)能使湿润的红色石蕊试纸变蓝的气体是氨气,证明铵根离子的存在,白色溶于氢氧化钠的沉淀是氢氧化铝,和Ba(OH)2溶液反应生成的白色不溶于硝酸的白色沉淀是硫酸钡;
(2)根据电荷守恒和原子守恒来计算回答;
(3)根据反应发生的先后顺以及消耗碱的量情况来回答.
解答: 解:(1)一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,故答案为:NH4+;Al3+;SO42﹣;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42﹣)= =0.2mol,n(NH4+)=
=0.2mol,n(NH4+)=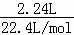 =0.1 mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42﹣)可得:n(Al3+)=
=0.1 mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42﹣)可得:n(Al3+)=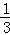 (2×0.2mol﹣0.1 mol)=0.1 mol,n(H2O)=
(2×0.2mol﹣0.1 mol)=0.1 mol,n(H2O)=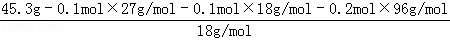 =1.2mol,所以,1.96g的该结晶水合物中:m(NH4+):n(Al3+):n(SO42﹣):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
=1.2mol,所以,1.96g的该结晶水合物中:m(NH4+):n(Al3+):n(SO42﹣):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
该结晶水合物的化学式为NH4Al(SO4)2•12H2O[或(NH4)2SO4•Al2(SO4)3•24H2O],
答:结晶水合物的化学式为NH4Al(SO4)2•12H2O[或(NH4)2SO4•Al2(SO4)3•24H2O];
(3)根据反应的先后顺序,开始阶段是氢氧化钠和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钠反应生成偏铝酸钠的阶段,结合Al3+~3OH﹣~Al(OH)3↓,NH4+~OH﹣,Al(OH)3↓~OH﹣~[Al(OH)4]﹣,所以三个阶段分别消耗的氢氧化钠的物质的量之比为:3:1:1,
即 ,故答案为:
,故答案为: .
.
点评: 本题考查离子的检验和推断,题目难度中等,注意从守恒的角度推断结晶水合物的化学式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法不科学的是( )
A. 自然界“水滴石穿”的主要原因用方程式表示为:CaCO3+H2O+CO2═Ca(HCO3)2
B. “雨后彩虹”是与胶体、光学等知识有关的自然现象
C. 人类目前直接利用的能量大部分是由化学反应产生的
D. “生物固氮”是指植物通过叶片直接吸收空气中的氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
在120℃的条件下,总质量为2.1g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为( )
A. 7.2g B. 4.2g C. 2.1g D. 3.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL 0.1mol•L﹣1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L﹣1 Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
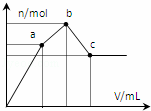
A. a点对应的沉淀只有BaSO4
B. c点溶液呈碱性
C. b点发生反应的离子方程式是:Al3++2SO42﹣+2Ba2++3OH﹣═Al(OH)3↓+2BaSO4↓
D. c点加入Ba(OH)2溶液的体积为200mL
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 28 g 氮气含有的原子数为NA |
|
| B. | 标准状况下,22.4 LH2O 中含有的水分子数为NA |
|
| C. | 1 mol 铁与稀硝酸反应时,失去的电子数不一定为3NA |
|
| D. | 0.5 mol/L Fe2(SO4)3 溶液中,SO42﹣ 的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 过量的NaHSO4与Ba(OH)2溶液反应 Ba2++OH﹣+H++SO42﹣═BaSO4↓+2H2O |
|
| B. | NH4HCO3溶液与过量的NaOH溶液反应 NH4++OH﹣═NH3↑+H2O |
|
| C. | 苯酚钠溶液中通入少量CO2 |
|
| D. | FeBr2溶液中通入过量Cl2 2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是4种短周期元素,它们的原子序数依次增大,其中甲和丙、乙和丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素的原子核中质子数之和的2倍,甲元素的一种核素核内无中子.
(1)丙、丁组成的常见化合物,其水溶液呈碱性,原因是
(用离子方程式表示);
写出两种均含甲、乙、丙、丁四种元素的化合物相互间发生反应,且生成气体的离子方程式 .
(2)丁的单质能跟丙的最高价氧化物的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 .
(3)甲、乙、丁可形成A、B两种微粒,它们均为﹣1价双原子阴离子,且A有18个电子,B有10个电子,则A与B反应的离子方程式为 .
(4)4.0g丁单质在足量的乙单质中完全燃烧放出37.0kJ热量,写出其热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要使用玻璃棒,其中玻璃棒作用相同的是( )
①过滤;②蒸发;③溶解;④向容量瓶中转移液体.
A. ①和④ B. ①和③ C. ③和④ D. ①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com