
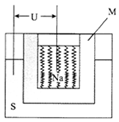
 如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.
如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx.该电池正极的电极反应式为xS+2e-=Sx2-.分析 原电池正极发生得电子的还原反应,结合原电池的总反应来分析正极反应;电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应、阴极上铜离子得电子发生还原反应;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,根据金属和电子之间的关系式计算.
解答 解:原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;
电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,阴极上铜离子得电子发生还原反应,阴极反应式为Cu2++2e-=Cu;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为25.6g,所以阳极溶解铜的质量为12.8g,
设通过的电子为x,
Cu-2e-=Cu2+
64g 2mol
12.8g x
64g:2mol=12.8g:x,
x=0.4mol,
故流经电镀池的电极的电子的物质的量为0.4mol,而流经电镀池的电子的量与流经原电池中正负极的电子的量相同,设原电池负极上有Xg钠被消耗,
有:Na-e-=Na+
23g 1mol
Xg 0.4mol
可得 X=$\frac{23g×0.4mol}{1mol}$
解得X=9.2g
故答案为:xS+2e-=Sx2-;9.2.
点评 本题考查了原电池原理和电解原理的应用,题目难度中等,明确各个电极上发生的反应、以及电子守恒是解本题关键,侧重于考查学生的分析能力和计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 2:5 | D. | 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
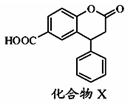
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与7molH2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com