

| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)-115.6 kJ | |
| D. | 若反应生成2mol液态水,放出的热量高于115.6kJ |
分析 A、催化剂改变反应速率,降低活化能;
B、依据反应物和生成物能量变化判断反应吸热放热,结合△H=反应物的总键能-生成物的总键能判断;
C、依据反应物和生成物能量变化判断反应吸热放热,据此书写热化学方程式;
D、依据气态水变成液态水还要放热判断.
解答 解:A、催化剂改变反应速率,降低活化能,所以曲线b是使用了催化剂,故A错误;
B、依据图象反应物的能量比生成物能量高,所以该反应为放热反应,又△H=反应物的总键能-生成物的总键能<0,则反应物的总键能小于生成物的总键能,故B错误;
C、依据图象反应物的能量比生成物能量高,所以该反应为放热反应,则反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)+115.6 kJ,故C错误;
D、由C反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)+115.6 kJ,又气态水变成液态水还要放热,所以若反应生成2mol液态水,放出的热量高于115.6 kJ,故D正确;
故选D.
点评 本题考查了热化学方程式书写及其键能与焓变之间的关系等,图象分析是关键,催化剂的作用分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题

| A. | 分子式为C7H6O5 | B. | 可发生取代反应 | ||
| C. | 可使酸性高锰酸钾溶液褪色 | D. | 不能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 矿物油和植物油都可以通过石油分馏来获取 | |
| B. | 硫酸亚铁可作补血剂组成成分 | |
| C. | 蛋白质的水解产物都是α-氨基酸 | |
| D. | 造成PM2.5的直接原因是土壤沙漠化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大 | |
| C. | 常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14 | |
| D. | 等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
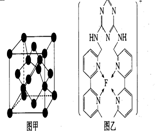 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: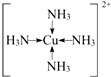 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com