

 ;
; +3NaOH $→_{高压}^{高温}$
+3NaOH $→_{高压}^{高温}$ +NaCl+2H2O;
+NaCl+2H2O; ;
; (任写一种结构简式).
(任写一种结构简式). 分析 由A的分子式为C7H8,最终合成对羟基苯甲酸丁酯可知,A为甲苯( ),甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为
),甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为 ,结合信息②可知,D中含有醛基,B在光照条件下,甲基上的H原子与氯气发生取代反应生成C,C为
,结合信息②可知,D中含有醛基,B在光照条件下,甲基上的H原子与氯气发生取代反应生成C,C为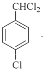 ,C在氢氧化钠水溶液中,甲基上的氯原子发生取代反应生成D,结合信息①可知,D为
,C在氢氧化钠水溶液中,甲基上的氯原子发生取代反应生成D,结合信息①可知,D为 ,D在催化剂条件下醛基被氧化生成E,E为
,D在催化剂条件下醛基被氧化生成E,E为 ,E在碱性高温高压条件下,结合信息③可知,苯环上的Cl原子被取代生成F,同时发生中和反应,F为
,E在碱性高温高压条件下,结合信息③可知,苯环上的Cl原子被取代生成F,同时发生中和反应,F为 ,F酸化生成对羟基苯甲酸G(
,F酸化生成对羟基苯甲酸G( ),最后发生中和反应得到对羟基苯甲酸丁酯,据此解答.
),最后发生中和反应得到对羟基苯甲酸丁酯,据此解答.
解答 解:由A的分子式为C7H8,最终合成对羟基苯甲酸丁酯可知,A为甲苯( ),甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为
),甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为 ,结合信息②可知,D中含有醛基,B在光照条件下,甲基上的H原子与氯气发生取代反应生成C,C为
,结合信息②可知,D中含有醛基,B在光照条件下,甲基上的H原子与氯气发生取代反应生成C,C为 ,C在氢氧化钠水溶液中,甲基上的氯原子发生取代反应生成D,结合信息①可知,D为
,C在氢氧化钠水溶液中,甲基上的氯原子发生取代反应生成D,结合信息①可知,D为 ,D在催化剂条件下醛基被氧化生成E,E为
,D在催化剂条件下醛基被氧化生成E,E为 ,E在碱性高温高压条件下,结合信息③可知,苯环上的Cl原子被取代生成F,同时发生中和反应,F为
,E在碱性高温高压条件下,结合信息③可知,苯环上的Cl原子被取代生成F,同时发生中和反应,F为 ,F酸化生成对羟基苯甲酸G(
,F酸化生成对羟基苯甲酸G( ),最后发生中和反应得到对羟基苯甲酸丁酯.
),最后发生中和反应得到对羟基苯甲酸丁酯.
(1)由上述分析可知,A为 ,化学名称为甲苯,D为
,化学名称为甲苯,D为 ,含有的官能团为:醛基、氯原子,
,含有的官能团为:醛基、氯原子,
故答案为:甲苯;醛基、氯原子;
(2)由B生成C是 在光照条件下,甲基上的H原子与氯气发生取代反应生成
在光照条件下,甲基上的H原子与氯气发生取代反应生成 ,
,
故答案为:取代反应;
(3)D的结构简式为 ,故答案为:
,故答案为: ;
;
(4)由E生成F的方程式为: +3NaOH $→_{高压}^{高温}$
+3NaOH $→_{高压}^{高温}$ +NaCl+2H2O,
+NaCl+2H2O,
故答案为: +3NaOH $→_{高压}^{高温}$
+3NaOH $→_{高压}^{高温}$ +NaCl+2H2O;
+NaCl+2H2O;
(5)某种结构的丁醇不能发生催化氧化反应,该丁醇为叔丁醇,由G与该丁醇生成对羟基苯甲酸丁酯的反应方程式: ,
,
故答案为: ;
;
(6)G( )的同分异构体中含有苯环且能发生银镜反应,侧链为-OH、-OOCH,有邻、间、对3种,侧链为2个-OH、1个-CHO,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,故共有9种,其中核磁共振氢谱有4种不同化学环境的氢的是:
)的同分异构体中含有苯环且能发生银镜反应,侧链为-OH、-OOCH,有邻、间、对3种,侧链为2个-OH、1个-CHO,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,故共有9种,其中核磁共振氢谱有4种不同化学环境的氢的是: 或
或 或
或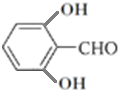 ,
,
故答案为:9; 等.
等.
点评 本题考查有机物合成和推断,是有机化学中的重要题型,有机合成过程主要包括官能团的引入、官能团的消除、官能团的衍变、碳骨架的变化等,注意根据分子式结合对羟基苯甲酸丁酯确定A的结构及发生的反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
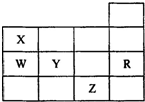 表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )
表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )| A. | 常温常压下,五种元素的单质中有两种是气态 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物比X的氢化物沸点高 | |
| D. | Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料及汽车尾气是造成雾霾天气的重要因素 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全地带 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 糖类、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| D. | 明矾可以用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O | D. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
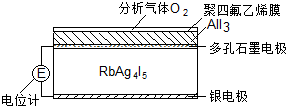 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体.这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体.目前固体电解质在制造全固态电池及| A. | 4AlI3+3O2=2Al2O3+6I2 | B. | I2+2Ag++2e-=2AgI | ||
| C. | Ag-e-=Ag+ | D. | I2+2Rb++2e-=2RbI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com