
分析 (1)据Fe+H2SO4=FeSO4+H2↑,中氢气的量算出生成固体铁的质量;
(2)消耗硫酸的物质的量为n(H2SO4)=0.0300mol,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeSO4溶液,根据硫元素守恒可知n(FeSO4)=n(H2SO4)=0.0300mol,根据铁元素守恒可知n(Fe)=2n(Fe2O3)=n(FeSO4),据此结合m=nM计算得到的Fe2O3的质量,并联系(1)分析固体可能含有的物质.
解答 解:(1)Fe+H2SO4=FeSO4+H2↑
56 22.4
1.12 0.448
则:m(Fe)=1.12g,故答案为:1.12;
(2)消耗硫酸的物质的量为n(H2SO4)=0.0300mol,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeSO4溶液,根据硫元素守恒可知n(FeSO4)=n(H2SO4)=0.0300mol,根据铁元素守恒可知n(Fe)=2n(Fe2O3)=n(FeSO4)=)=0.0300mol,故n(Fe2O3)=$\frac{0.03mol}{2}$=0.015mol,
m(Fe2O3)=0.015mol×160g/mol=2.4g,m(Fe)=1.12g,固体物质X质量1.84g,介于1.12g~2.4g,故X物质中除含Fe外,还可能含有的物质是Fe2O3,
故答案为:Fe2O3.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 消耗硫酸亚铁铵的物质的量为n(2-x)mol | |
| B. | 处理废水中Cr2O72- 的物质的量为nxmol | |
| C. | 反应中发生转移的电子数为3n mol | |
| D. | 在FeO•FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
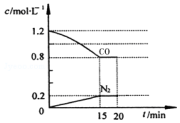 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
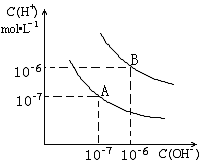 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
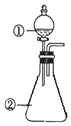 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com