
(4分)简要说明下列实验失败的主要原因:
(1) 做蔗糖水解实验:在试管内加少量蔗糖溶液,再加3─5 mL稀H2SO4,小心煮沸几分钟后,冷却。取少量冷却液加入装有新制Cu(OH)2悬浊液的试管中,加热到沸腾,无砖红色沉淀产生。原因是____________________________________________________。
(2) 将醋酸钠晶体(CH3COONa?3H2O)与干燥碱石灰按一定质量比混合后加热,为什么会几乎没有甲烷生成?_____________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
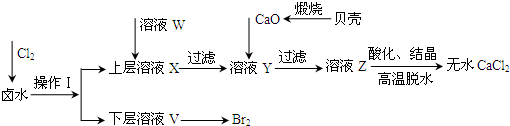
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
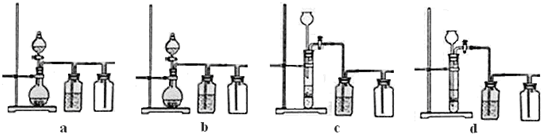
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2OFe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③ 所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③ 、④ 、⑤ 、⑥ (可不填满)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com