
| A、AlCl3溶液中滴加足量氨水:Al3++4OH-=AlO2-+2H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| D、钠和水反应:Na+2H2O=Na++2OH-+H2↑ |


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4L氟化氢中含原子数为2NA |
| B、常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子 |
| C、电解1L食盐水若产生1 g氢气,则所得溶液PH值为14 |
| D、100mL 0.1mol?L-1的FeCl3溶液中含有Fe3+的个数为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| B、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、用浓盐酸酸化的KMnO4与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C、硝酸银中加入铜:2Ag++Cu=2Ag+Cu2+ |
| D、氢氧化钡中加入硫酸:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一. 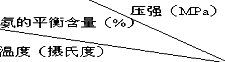 | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有HBr,可能含有CO2、Cl2 |
| B、一定不含CO2 |
| C、一定不含NH3、Cl2 |
| D、可能含有Cl2、CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com