
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A.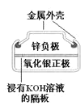 正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B. 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
C.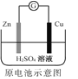 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
D.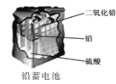 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
【答案】C
【解析】
A.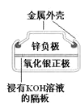 正极为Ag2O,Ag2O得电子的产物与水反应生成Ag和OH-,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,A正确;
正极为Ag2O,Ag2O得电子的产物与水反应生成Ag和OH-,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,A正确;
B. 锌的金属活动性强,锌筒作负极,失电子发生氧化反应,Zn-2e-=Zn2+,生成的Zn2+进入溶液,所以锌筒会变薄,B正确;
锌的金属活动性强,锌筒作负极,失电子发生氧化反应,Zn-2e-=Zn2+,生成的Zn2+进入溶液,所以锌筒会变薄,B正确;
C.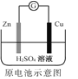 Zn作负极,Cu作正极,阳离子(Zn2+)向正极(Cu电极)方向移动,Cu电极发生反应:2H++2e-=H2↑,所以Cu电极附近溶液中H+浓度减小,C不正确;
Zn作负极,Cu作正极,阳离子(Zn2+)向正极(Cu电极)方向移动,Cu电极发生反应:2H++2e-=H2↑,所以Cu电极附近溶液中H+浓度减小,C不正确;
D.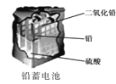 负极反应为:Pb-2e-+
负极反应为:Pb-2e-+![]() =PbSO4,正极反应为PbO2+2e-+4H++
=PbSO4,正极反应为PbO2+2e-+4H++![]() =PbSO4+2H2O,使用一段时间后,电解质溶液的酸性减弱,导电能力下降,D正确;
=PbSO4+2H2O,使用一段时间后,电解质溶液的酸性减弱,导电能力下降,D正确;
故选C。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的的是

A.用图1所示装置制取氨气
B.用图2所示装置证明非金属性强弱:S>C> Si
C.用图3所示装置证明酸性强弱:硝酸>碳酸>硅酸
D.用图4所示装置制备少量的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷(CH4)是一种温室气体,NO是常见大气污染物,为消除空气中少量的CH4和NO,工业上可以设计如下反应:CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:
2N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别将0.40 mol CH4和1.60 mol NO充入体积为2 L的恒容密闭容器中,n(CH4)随反应时间的变化如图所示:

(1)根据上图判断该反应的T1________T2。(填“>”“<”或“=”)
(2)温度为T1,0~10 min内NO的平均反应速率v(NO)=___________,反应开始和平衡时容器的压强之比为___________。
(3)温度为T2,反应达到平衡时,NO的转化率为___________(保留3位有效数字)
(4)下列条件的改变不能加快反应速率的是___________。(填字母)
A.加入合适的催化剂 B.缩小容器体积
C.将CH4由0.4 mol改为0.8 mol D.分离出产物CO2
(5)CH4是重要的化石能源,完全燃烧生成CO2和H2O,放出大量热。若以熔融的K2CO3为电解质,可以设计成一种高温燃料电池,正极通入的气体是空气和CO2,负极反应式为:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋氨酸铜[Cux(Met)y,Met表示蛋氨酸根离子]是一种新型饲料添加剂。为确定蛋氨酸铜[Cux(Met)y]的组成,进行如下实验:
(1)称取一定质量的样品于锥形瓶中,加入适量的蒸馏水和稀盐酸,加热至全部溶解,冷却后将溶液分成两等份。
②取其中一份溶液,调节溶液pH在6~8之间。加入0.1000 mol/LI2的标准溶液25.00 mL,充分反应后滴入2~3滴指示剂X,用0.1000 mol/LNa2S2O3标准溶液滴定至蓝色恰好褪去,发生反应:![]() 。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
。消耗Na2S2O3标准溶液22.00 mL(蛋氨酸与I2反应时物质的量之比为1:1,产物不与Na2S2O3发生反应)。
③向另一份溶液中加入NH3·H2O-NH4Cl缓冲溶液,加热至70℃左右,滴入2-3滴指示剂PAN,用0.02500 mol/LEDTA (Na2H2Y)标准溶液滴定其中Cu2+(离子方程式为Cu2++H2Y2--=CuY2-+2H+),消耗EDTA标准溶液28.00 mL。
(1)指示剂X为 ____。
(2)用Na2S2O3标准液滴定时,若pH过小,会有S和SO2生成。写出S2O32-与H+反应的离子方程式 ___________ 。
(3)若滴定管水洗后未用EDTA标准溶液润洗,测得Cu2+的物质的量将____(填“偏大”、“偏小”或“不变”)。
(4)通过计算确定蛋氨酸铜[Cux(Met)y]的化学式(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
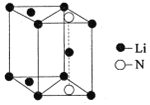
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,请回答下列有关问题:
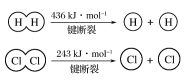
①由H+H→H2,当形成1 mol H—H键时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl—Cl键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
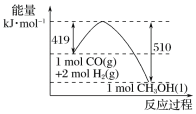
(2)①根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”) ________kJ能量。
②1mol CO(g)的总键能_______(填“>”、“=”或“<”)1mol CH3OH(l)的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”,已知:Cu2+ +4NH3.H2O= 4H2O+[Cu(NH3)4]2+ (该反应产物可作为H2O2分解的催化剂)。下列有关分析错误的是
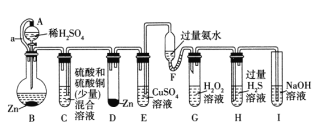
A.该实验成功的重要条件是整套装置气密性良好
B.A和B之间导管a的作用是平衡A和B内气压
C.B中反应速率大于D中反应速率
D.H中出现浅黄色浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成抗抑郁药物Prolitane的路线如下:
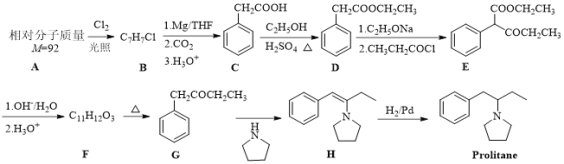
请回答以下问题:
(1)A的结构简式为_______。D的化学名称为_______,
(2)D→E的反应类型为_______。
(3) E的官能团名称为_______。
(4)F→G的化学方程式为_______。
(5) X 是D的同系物,满足下列条件的X共 ________种(不含立体异构)
①分子组成比D少一个CH2②能发生银镜反应③苯环上有两种不同化学环境的H,其中核磁共振氢谱显示为5组峰,其峰面积比为3∶2∶2∶2∶1,写出符合该要求的X的一种同分异构体的结构简式:_________________。
(6)参照Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
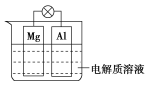
(1)电解质溶液为稀硫酸时,灯泡亮, Mg电极上发生的反应为____________;Al电极上发生的反应为________。溶液中![]() 向________移动(填“Mg电极”或“Al电极”)
向________移动(填“Mg电极”或“Al电极”)
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。_______________
a.若灯泡亮,Al电极为_______________(填“正极”或“负极”)。
b.若灯泡不亮,其理由为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com