
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |


科目:高中化学 来源: 题型:
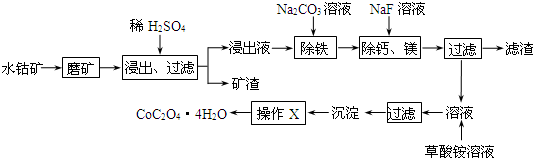
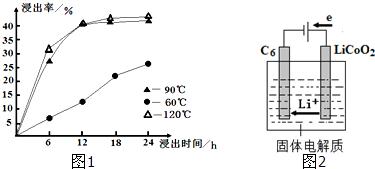
| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol水的摩尔质量和1 mol水的摩尔质量 |
| B、200mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 1 mol/L氯化钾溶液中c(Cl-) |
| C、64g二氧化硫中的氧原子数和标准状况下22.4L二氧化碳中的氧原子数 |
| D、2mol/LBa(OH)2溶液中Ba2+的物质的量和OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

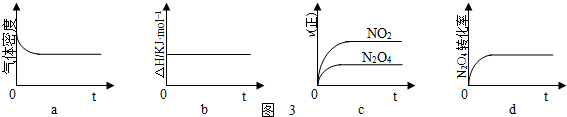
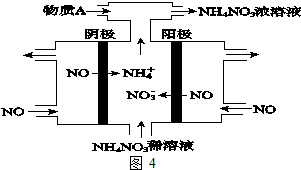
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S分子中,S为sp杂化,为直线形 |
| B、BCl3中B原子sp2杂化,为平面三角形 |
| C、CS2中C原子sp杂化,为直线形 |
| D、PCl3中P原子sp3杂化,为三角锥形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com