
【题目】下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊
D.水中加入明矾可以净化水
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
测定过氧化氢的含量请填写下列空白:
(1)移取10.00 m密度为ρ g·mL-1的过氧化氢溶液至250mL______________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,己知MnO4-被还原成Mn2+。写出反应的离子方程式:_____________________________
(3)滴定时,将高锰酸钾标准溶液注入_________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_______________________________________。
(4)反复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为__________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。右图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是

A.该装置将化学能最终转化为电能
B.a处通入O2
C.b处为电池正极,发生还原反应
D.通入O2的电极上发生的电极反应为O2 +4H+ +4e–=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:

(1)步骤①反应的离子方程式是_______________________________________,
步骤③反应的化学方程式是_______________________________________。
(2)从理论上考虑,下列物质也能吸收Br2的是________________。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是____________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是造成雾霾天气的重要原因之一,尾气中的主要污染物为CxHy、NO、CO、SO2及固体颗粒物等。研究汽车尾气的成分及其发生的反应,可以为更好的治理汽车尾气提供技术支持。请回答下列问题:
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是 。
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000 molNO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:

根据上表数据,写出容器中发生反应的化学方程式 并判断p 3.93MPa(用“>”、“<"或“=”填空)。计算反应体系在200℃时的平衡常数Kp (用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)汽车尾气中的S02可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaS03与水形成的浊液pH为9,已知Kal(H2S03)=1.8×10-2 ,Ka2(H2S03)=6.0 ×10-9,忽略SO32-的第二步水解,则Ksp(CaS03)= 。
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H20(1)=CO(g)+3H2 (g) △H=+250.1 kJ/mol。已知CO(g)、H2 (g)的燃烧热依次为283.0kJ/mol、285.8 kJ/mol,请写出表示甲烷燃烧热的热化学方程式 。以CH4 (g)为燃料可以设计甲烷燃料电池,该电池以稀H2 S04作电解质溶液,其负极电极反应式为 ,已知该电池的能量转换效率为86. 4%,则该电池的比能量为 kW.h.kg-1(结果保留1位小数,比能量=![]() ,lkW·h= 3. 6×1 06J) 。
,lkW·h= 3. 6×1 06J) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
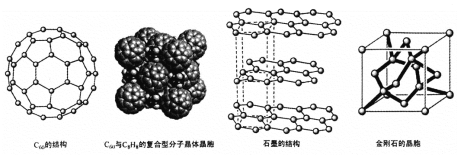
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸,再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为( )
A.0.1mol B.大于或等于0.2mol,小于0.3mol
C.等于0.2 mol D.大于0.1mol小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入到20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( )

A. V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-)
B. V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C. V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-)
D. pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com