
| A. | 五种 | B. | 四种 | C. | 三种 | D. | 二种 |
分析 中学常见既能与酸又能与碱反应的物质有:Al、氧化铝、氢氧化铝、弱酸的酸式盐、弱酸对应的铵盐、蛋白质、氨基酸等.
解答 解:①NaHCO3属于弱酸酸式盐,能跟盐酸反应又能跟NaOH溶液反应,故选;
②Al(OH)3属于两性氢氧化物,能跟盐酸反应又能跟NaOH溶液反应,故选;
③Al能与盐酸反应生成氯化铝与氢气,与氢氧化钠溶液反应生成偏铝酸钠与氢气,故选;
④(NH4)2CO3于弱酸的铵盐盐,能跟盐酸反应又能跟NaOH溶液反应,故选;
⑤Al2O3属于两性氧化物,能跟盐酸反应又能跟NaOH溶液反应,故选,
故选A.
点评 本题考查元素化合物性质,难度不大,关键是元素化合物性质的掌握,注意归纳总结常见能与酸、碱反应的物质.


科目:高中化学 来源: 题型:选择题
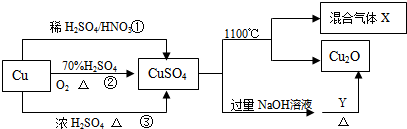
| A. | 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体 | |
| B. | 相对于途径①③,途径②更好地体现了绿色化学思想 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可能是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的已排尽空气的干燥玻璃管中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液出现白色沉淀 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
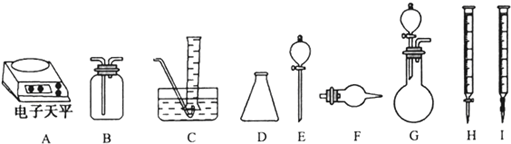
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字表示) | 实验需直接测定的有关物理量(用文字说明) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中无法确定Al3+的存在 | |
| B. | 原溶液中不含的离子为:K+、Cu2+、CO32- | |
| C. | 步骤②中可以确定存在Cl-、Fe2+、NO3- | |
| D. | 步骤③中共有2种钡盐沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
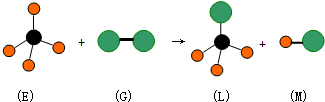
| A. | 反应过程中E中共价键断裂,G中共价键保持不动 | |
| B. | E中存在非极性键 | |
| C. | M分子有可能是HCl | |
| D. | 上述反应的类型是加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com