
下列说法正确的是
A.氢氧燃料电池工作时,H2在负极上失去电子
B.0.1 mol/L Na2CO3溶液加热后,溶液的pH减小
C.常温常压下,22.4 L Cl2中含有的分子数为6.02×1023个
D.室温下,稀释0.1 mol/L CH3COOH溶液,溶液的导电能力增强
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
下列实验操作或叙述中正确的是
A. 蒸发操作时,应使混合物中的水分完全蒸干后再停止加热
B. 蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上口进下口流出
C. 过滤后洗涤沉淀时,应将固体转移至烧杯中,并加入适量蒸馏水充分搅拌后再过滤
D. 分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从上口放出上层液体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
mX(g)+nY(g)  qZ(g) △H<0, m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g) △H<0, m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源:
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol﹣1,其能量变化示意图如下: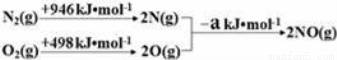
则NO中氮氧键的键能为 kJ•mol﹣1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行 ,并说出理由
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=﹣b kJ•mol﹣1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是 ;
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
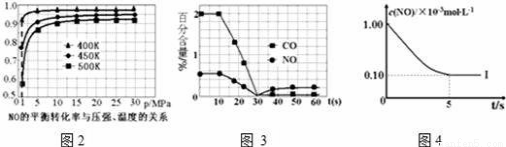
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是 ;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是 ;
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
实验编号 | T(K) | NO初始浓度 (mol•L﹣1) | CO初始浓度 (mol•L﹣1) | 催化剂的比表面积 (m2/g) |
Ⅰ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 82 |
Ⅱ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
Ⅲ | 450 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为 ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
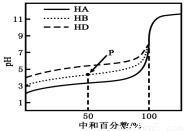
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始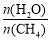 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时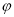 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中 =3
=3
D.温度不变时,图中X点对应的平衡在加压后 (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:实验题
I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀 锡工业。某研究小组设计SnSO4制备路线如下:
锡工业。某研究小组设计SnSO4制备路线如下:
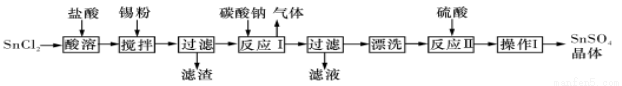
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO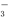 )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO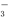 )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO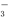 )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:选择题
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
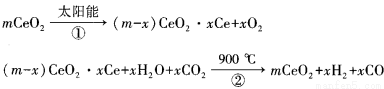
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—= CO32—+2H2O
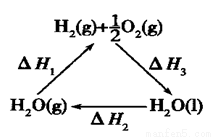
D.上图中△H1=△H2+△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中文化学试卷(解析版) 题型:选择题
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒, 因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com