
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
甲同学设计实验的目的是 , 烧杯 (填字母)中的反应最剧烈。
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证氮、碳、硅元素的非金属性强弱。

乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A: ;B: ; C: 。
(2)写出烧杯中发生反应的离子方程式:
(3)该装置存在着某个缺陷,改进的方法是
【答案】(Ⅰ)验证锂、钠、钾的活动性(或同一主族,从上到下元素的金属性逐渐增强),c ;
(Ⅱ)(1)HNO3、 CaCO3、Na2SiO3(或K2SiO3) ;(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;(3)在B、C 之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶。
【解析】试题分析:(I)Li、Na、K属于同一主族,根据元素周期律,同一主族同上到下,原子半径增大,金属性增强,因此实验目的是验证Li、Na、K的活动性或探究同一主族金属性的递变的性质,钾的活动性最强,反应最剧烈;(II)A是强酸,常温下可与Cu反应,则A为HNO3,验证三种元素的非金属性,可以通过最高价氧化物对应水化物的酸性强弱进行比较,酸性越强,非金属性越强,因为B是块状固体,因此B为CaCO3,C为Na2SiO3;(2)利用酸性强的制取酸性弱的,其离子反应方程式为:2H++CO32-=CO2↑+H2O,CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;(3)因为硝酸挥发,会对后面的实验产生干扰,必须除去,因此在B、C 之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
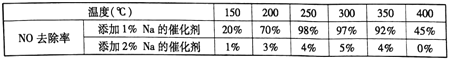
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于X、Y、Z三种元素,有以下五点信息
① X、Y、Z的单质在常温下均为气体;
② X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③ XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
④ 每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤ Z单质溶于X2Y中,所得溶液具有漂白性。
(1)试写出Z的元素符号______;化合物XZ的电子式:_______,X2Y的结构式_________。
(2)用电子式表示XZ的形成过程_________________________________________________。
(3)写出信息⑤中的化学方程式__________________________________________________。
(4)X2、Y2和KOH溶液一起可以构成新型燃料电池,写出该电池的总反应方程式:
_______________________
已知拆开1mol X—X键、1mol Z—Z键、1mol X—Z键分别需要吸收的能量为436kJ、243kJ、432kJ,计算反应X2(g)+Z2(g)=2XZ(g)的ΔH=________kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____区。基态Al原子的L层电子排布图为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________,1mol乙酸分子中含有的σ键的数目为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____。碳、硼、氮元素的电负性由大到小的顺序是_____。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____g·cm-3(设阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )
A.盐酸和NaOH溶液混合
B.氯化氢溶于水
C.溴化氢气体与氨气相遇反应
D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
A.该合成中所有的电能和热能全部转化为化学能
B.该合成氨过程不属于氮的固定
C.空气、水、太阳能均为可再生资源
D.断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com