
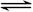 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1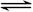 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。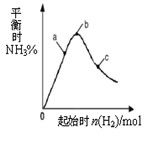
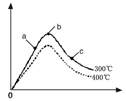 (2分) ② a(2分)
(2分) ② a(2分) 。
。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.任何化学反应不一定都有反应热 |
| B.使用催化剂可以改变反应的平衡常数 |
| C.升高温度使反应加快,是因为降低了反应的活化能 |
| D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 |
| B.氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
| C.在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大 |
D.在一密闭容器中发生2SO2+O2 2SO3反应,增大压强,平衡会正向移动, 2SO3反应,增大压强,平衡会正向移动,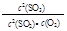 的值增大 的值增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2+I2
H2+I2
 2HI(g)的平衡常数K=__________________
2HI(g)的平衡常数K=__________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: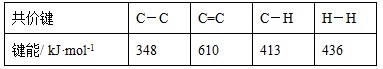 则可以计算出反应 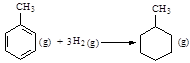 的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应, 则该反应是吸热反应 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)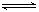 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% |
| D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
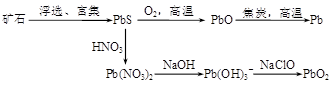
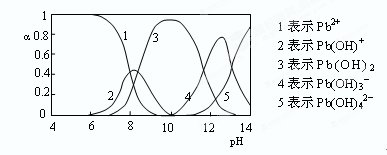
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H>0的反应,常温下一定不能自发进行 |
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线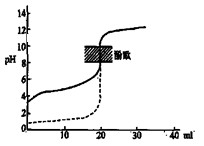 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com